Méthanol - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Méthanol | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | alcool méthylique | ||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore, d'odeur caractéristique. | ||
| Propriétés chimiques | |||
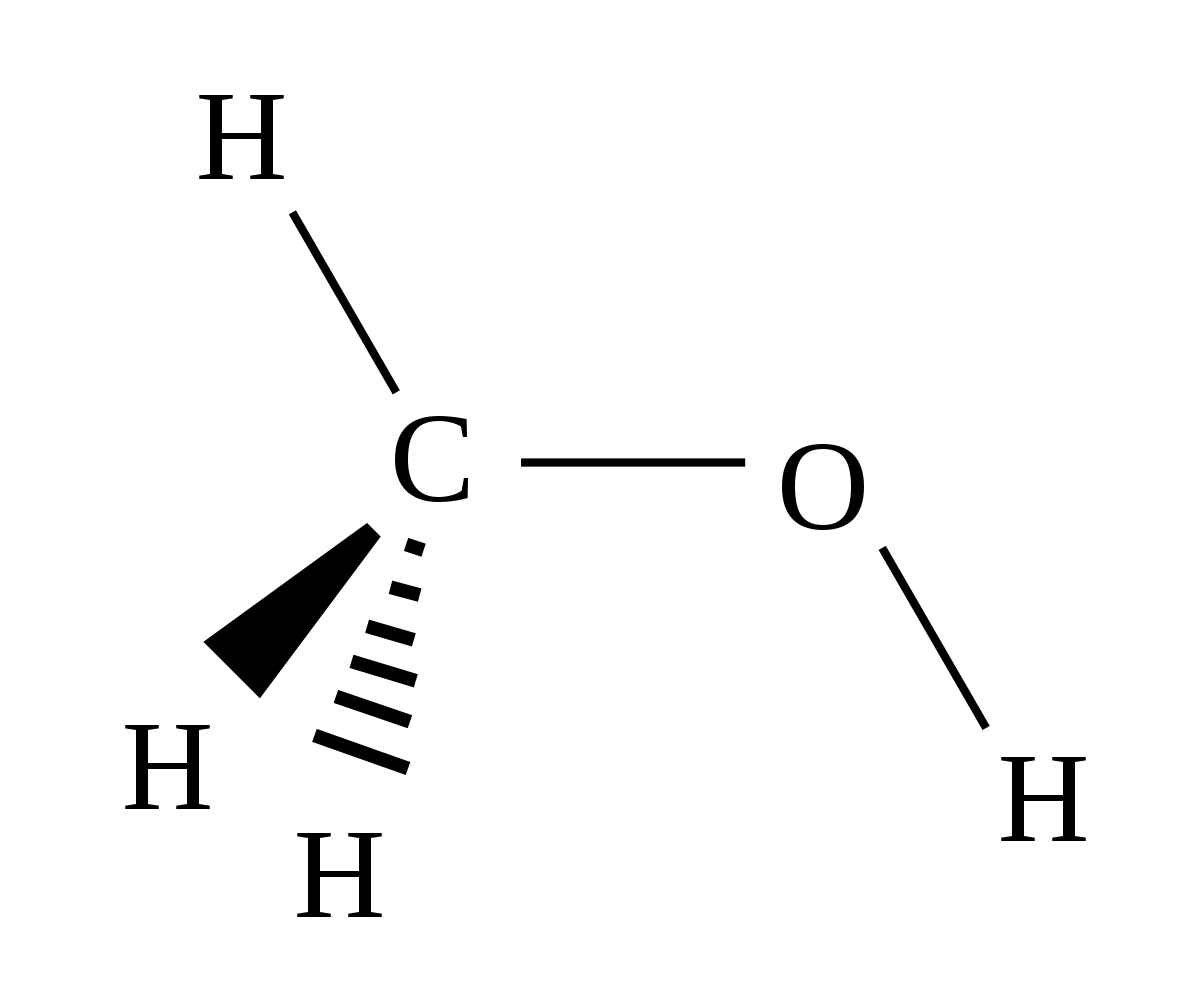
| Formule brute | CH4O | ||
| Masse molaire | 32,0419 ± 0,0014 g·mol-1 | ||
| Moment dipolaire | 1,70 ± 0,02 D | ||
| Diamètre moléculaire | 0,408 nm | ||
| Propriétés physiques | |||
| T° fusion | -98 °C | ||
| T° ébullition | 65 °C | ||
| Solubilité | dans l'eau : miscible | ||
| Masse volumique | 0,7910 g·cm-3 | ||
| T° d’auto-inflammation | 464 °C | ||
| Point d’éclair | 12 °C (coupelle fermée) | ||
| Limites d’explosivité dans l’air | Inférieure : 5,5 Vol% Kohn-Birett Supérieure : 31 Vol% Kohn-Birett | ||
| Pression de vapeur saturante | à 20 °C : 12,3 kPa, 410 mmHg à 50 °C | ||
| Viscosité dynamique | 0,5513 mPa·s à 25 °C (liquide) | ||
| Point critique | 239,35 °C, 8,08 MPa, 0,117 l·mol-1 | ||
| Conductivité thermique | 190,16 mW m-1 K-1 à 25 °C (liquide) | ||
| Conductivité électrique | 5.10-9 Ω-1 cm-1 à 25 °C | ||
| Thermochimie | |||
| S0 | 186,9 J/mol.K | ||
| S0 | 127,19 J/mol.K | ||
| S0 | 1,117 J/mol.K | ||
| ΔH0 | -201,54 kJ·mol-1 | ||
| ΔH0 | -239,00 kJ·mol-1 | ||
| Cp | 79,5 J/mol.K | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 10,85 ± 0,01 eV (gaz) | ||
| Cristallographie | |||
| Classe cristalline ou groupe d’espace | P212121 | ||
| Paramètres de maille | a = 4,873 Å b = 4,641 Å | ||
| Volume | 200,53 Å3 | ||
| Densité théorique | 1,061 | ||
| Propriétés optiques | |||
| Indice de réfraction |
| ||
| Précautions | |||
| | |||
| |||
| Phrases R : 11, 23/24/25, 39/23/24/25, | |||
| Phrases S : 7, 16, 36/37, 45, | |||
| | |||
| |||
| | |||
|
3 1 0 | |||
| | |||


| |||
| | |||


Danger | |||
| Inhalation | Toxique, peut être mortelle. | ||
| Peau | assèchement | ||
| Yeux | dangereux, rend aveugle. | ||
| Écotoxicologie | |||
| LogP | -0,82/-0,66 | ||
| Seuil de l’odorat | bas : 4,2 ppm haut : 5 960 ppm | ||
| | |||
Le méthanol, également connu sous le nom d’alcool méthylique, de carbinol, d’alcool de bois, de naphte de bois ou d’esprit de bois est un composé chimique de formule : CH3OH (souvent abrégé en MeOH). C’est le plus simple des alcools, et il se présente sous la forme d’un liquide léger, volatil, incolore, inflammable, toxique avec une odeur caractéristique un peu écœurante, plus douce et sucrée que celle de l’éthanol (alcool éthylique). À température ambiante, c’est un liquide polaire utilisé comme antigel pour liquide de refroidissement, comme solvant, comme carburant (en aéromodélisme) et comme dénaturant de l’alcool éthylique dont il est indissociable par distillation. Il est également utilisé pour la production de biodiesel par réaction de trans-estérification.
Le méthanol est produit naturellement par le métabolisme des organismes anaérobies de nombreuses variétés de bactéries. En conséquence, il existe une petite fraction de vapeur de méthanol dans l'atmosphère. Au bout de plusieurs jours, le méthanol atmosphérique est oxydé par l'oxygène de l’air avec l’action favorisante de la lumière du soleil pour former du dioxyde de carbone et de l'eau.
Le méthanol brûle dans l'air en formant du dioxyde de carbone et de l'eau :
- 2 CH3OH + 3 O2 → 2 CO2 + 4 H2O
La flamme de méthanol est presque incolore. Il faut se méfier de la combustion du méthanol pour éviter de se brûler sur un feu presque invisible.
En raison de ses propriétés toxiques, le méthanol est fréquemment utilisé comme additif dénaturant pour l'éthanol fabriqué à usage industriel, cet ajout d'un poison permet aux industriels de l'éthanol d’économiser le versement des énormes taxes sur les alcools qui sont perçues sur toutes les boissons alcoolisées. Le méthanol est souvent appelé alcool de bois, car il était autrefois considéré surtout comme un sous-produit de la distillation du bois. Il est désormais fabriqué par synthèse au cours d’un processus qui se déroule en plusieurs étapes. En résumé, du gaz naturel et de la vapeur sont reformés dans un four pour produire de l'hydrogène et du monoxyde de carbone, ensuite l'hydrogène et le monoxyde de carbone en mélange gazeux à haute pression réagissent ensemble en présence d'un catalyseur.





















































