ADN polymérase - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Une ADN polymérase est un complexe enzymatique intervenant dans la réplication de l’ADN au cours du cycle cellulaire, mais aussi dans des processus de réparation et de recombinaison de l'ADN. Il existe différentes familles de polymérases qui diffèrent selon leurs séquences en acide aminé et leurs propriétés catalytiques.
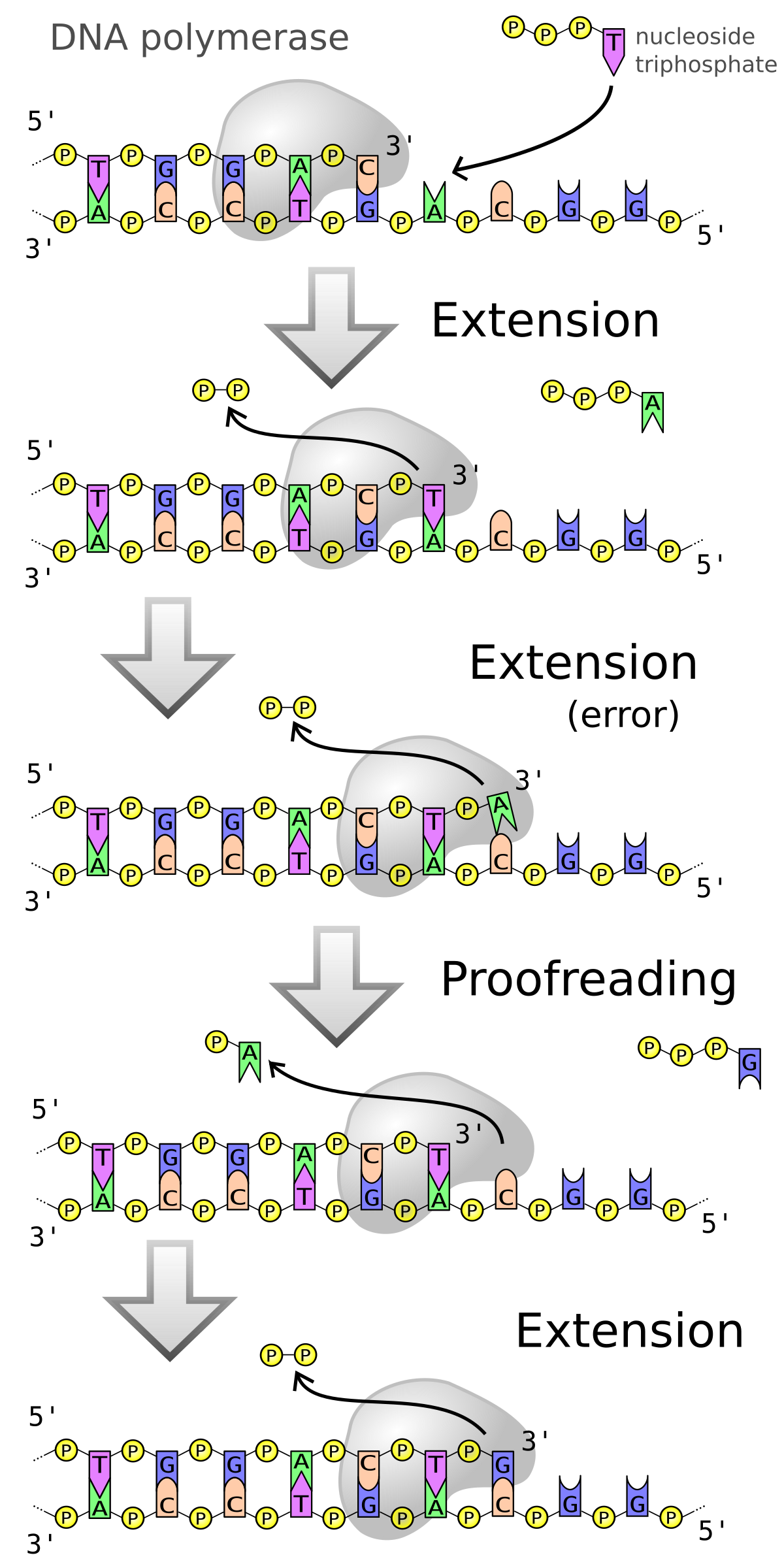
Toutes les ADN polymérases synthétisent l’ADN dans le sens 5'-3', chez tous les organismes vivants, et aucune n’est capable de commencer une nouvelle chaîne sans amorces. Elles ne peuvent que rajouter des nucléotides à partir d’une amorce préexistante à l’extrémité 3’-OH. Pour cette raison l’ADN polymérase a besoin d’une amorce (ou primer), sur laquelle elle pourra ajouter de nouveaux oligonucléotides. L’amorce peut être formée d’ADN ou d’ARN in vitro et d'ARN in vivo et est synthétisée par une autre enzyme, appelée primase. Une enzyme, hélicase, est ensuite requise pour délier le double brin de l’ADN et ainsi faciliter l’accès des ADN polymérases sur les brins d’ADN, devenu simple brin, et permettre ainsi la réplication. Les ADN polymérases intervenant dans la réplication sont associées au sein d'un complexe multiprotéique appelé réplisome.
Les ADN polymérases possèdent une structure très conservée. Elles sont considérées comme étant des holoenzymes puisqu’elles ont besoin d’un ion magnésium comme cofacteur pour fonctionner correctement. En absence d’ions magnésium, elles sont appelées apoenzymes.
Les ADN polymérases ont la capacité de corriger les erreurs dans la formation de brin néoformé. Lorsqu'une paire de base incorrecte est reconnue, l’ADN polymérase va revenir en arrière grâce à son activité 3’-5’ exonucléase, va réinsérer la base correcte, et reprendre la réplication.
ADN polymérases bactériennes
Cinq ADN polymérases ont été identifiées chez les bactéries:
- Pol I : impliquée dans la réparation de l’ADN. Elle possède les deux activités polymérase 5'→3' et exonucléase 3'→5' (fragment de Klenow), et participe à la synthèse des fragments d’Okazaki. Elle intervient aussi en fin de réplication pour éliminer les amorces d'ARN (activité exonucléase 5'-3').
- Pol II : impliquée dans la réplication de l'ADN endommagé et possède activité exonucléase 5'→3' .
- Pol III : c’est la principale polymérase bactérienne qui intervient dans l'élongation de la chaîne d'ADN lors de la réplication au niveau du brin avancé et de la synthèse des fragments d’Okazaki. Elle est constituée de dix sous-unités. On définit une structure minimale (core enzyme αεθ) comprenant une sous-unité α (activité polymérase), une sous-unité ε (exonucléase 3'→ 5') et une sous-unité θ de fonction inconnue. Deux cores (αεθ) et un complexe γ (facteur de chargement) sont maintenus ensemble par l'intermédiaire d'un connecteur, la protéine t.
- Pol IV : ADN polymérase de la famille Y.
- Pol V : ADN polymérase de la famille Y.
ADN polymérases chez les Archaea
- Polymérase B : Toutes les ADN polymérases de type B identifiées chez les Archaea présentent une activité 5' vers 3' et une activité exonucléasique 3' vers 5'. Elles sont constituées d'une seule sous-unité.
- Polymérase D : Ces ADN polymérases trouvées chez les Euryarchaeotes sont constituées de deux sous-unités différentes. La grande sous-unité DP2 possède l'activité catalytique, mais seulement en présence de la petite sous-unité DP1.