Constante d'équilibre - Définition
La liste des auteurs de cet article est disponible ici.
Utilisation
Pour le calcul de la constante d'équilibre, les valeurs des activités des différentes espèces mises en jeu sont prises en compte lorsque l'équilibre de la réaction est atteint. Si l'on change l'activité chimique de l'une des espèces mises en jeu (en changeant la concentration d'une espèce en solution ou la pression partielle d'un gaz), alors l'équilibre est déplacé (si la réaction était en état d'équilibre, à cause de cette modification elle n'est plus à l'équilibre).
Facteur d'équilibre
Un facteur d'équilibre est une variable d'état qui, lorsqu'elle est modifée, déplace l'équilibre de la réaction.
Variables d'état
Une variable d'état caractérise l'état d'équilibre du système, par exemple :
- La pression de l'air ;
- La pression des espèces gazeuses participant à la réaction ;
- La température ambiante ;
- Les concentration molaires des espèces dissoutes.
Quelques facteurs d'équilibre
Voici une liste non exhaustive des principaux facteurs d'équilibre :
- température ;
- pressions des espèces gazeuses participant à la réaction ;
- concentrations molaires des solutés (espèces dissoutes) participant à la réaction.
Quotient de réaction
Le quotient de réaction permet de caractériser l'état d'avancement d'une réaction, et ainsi de prévoir son évolution. C'est la valeur prise par l'expression de la constante d'équilibre lorsque le système réactionnel est hors équilibre
Formule générale
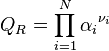
Utilisation
Pour prévoir le sens d'évolution du système on compare constante d'équilibre et quotient de réaction de la réaction étudiée ; le système devant évoluer vers QR = K(T):
- Si QR = K(T) le système est à l'équilibre
- Si QR < K(T) le système va évoluer dans le sens qui fait augmenter la valeur de la fonction des concentrations (ou encore dans le sens qui fait diminuer les quantités des réactifs et augmenter les quantités des produits) pour atteindre K, c'est-à-dire la réaction spontanée est celle qui évolue dans le sens direct.
- Si QR > K(T) le système va évoluer dans le sens qui fait diminuer la valeur de la fonction des concentrations (ou encore dans le sens qui fait augmenter les quantités des réactifs et diminuer les quantités des produits) pour atteindre K, c'est-à-dire la réaction spontanée est celle qui évolue dans le sens inverse.
en effet, c'est grâce à la loi de modération qu'on a pu tirer ces conclusions.

















































