Acide sulfureux - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Acide sulfureux | |||
|---|---|---|---|
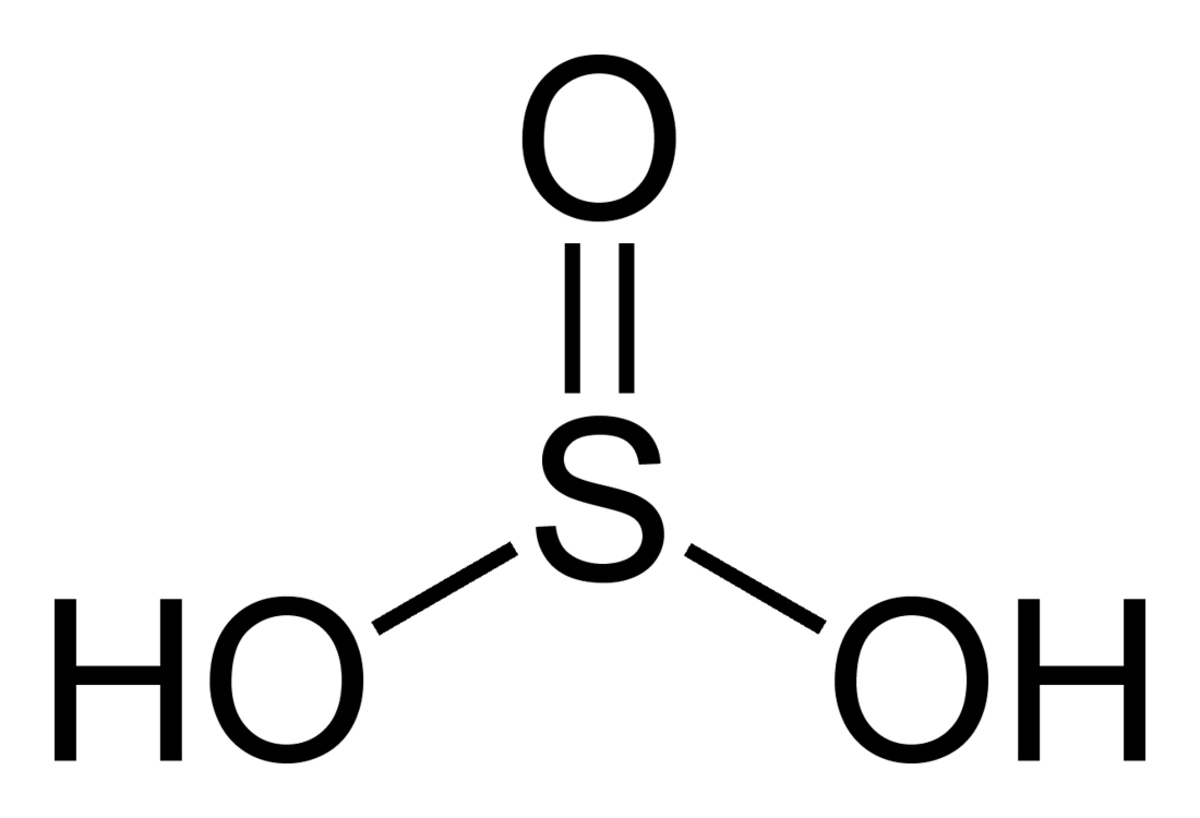
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| Propriétés chimiques | |||
| Formule brute | H2SO3 | ||
| Masse molaire | 82,079 ± 0,006 g·mol-1 | ||
| pKa | 1,8 | ||
| Propriétés physiques | |||
| Solubilité | Miscible à l'eau | ||
| Masse volumique | 1,03 g·cm-3 (20 °C) | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 20, 34, | |||
| Phrases S : 26, 36/37/39, 45, | |||
| | |||
| |||
| | |||

| |||
| | |||
L'acide sulfureux est un acide hypothétique à base de soufre de formule H2SO3. Même en solution aqueuse, l'acide sulfureux n'existe vraisemblablement pas sous sa forme non-protolysée ; toutefois, la molécule a été détectée en phase gazeuse.
Les bases conjuguées de cet acide sont quant à elles communes : l'anion hydrogénosulfite de formule HSO3- et l'anion sulfite de formule SO32-.
Description
L'acide sulfureux est un acide fabriqué à l'aide d'eau et de dioxyde de soufre (SO2) selon la réaction :
SO2 (g) + H2O (l) → H2SO3 (aq) K << 10-9
Cependant, en réalité, la molécule d'acide sulfureux n'existe pour ainsi dire pas en solution aqueuse et l'équilibre de la réaction conduit immédiatement à la création de ions hydrogénosulfite et sulfite :
SO2 (g) + 2 H2O → H3O+ + HSO3- pKa = 1,8
HSO3- + H2O → H3O+ + SO32- pKa = 7,0
Ces solutions acides sont utilisées comme conservateur alimentaire, notamment pour les fruits secs, le vin et la conservation de la viande.


















































