Acide - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Un acide est un composé chimique généralement défini par ses réactions avec un autre type de composé chimique complémentaire, les bases.
Définitions
L’acidité fut d’abord définie par Svante August Arrhenius à la fin du XIXe siècle : un acide est un composé chimique pouvant libérer des protons (ions H+) en solution aqueuse et une base un composé chimique pouvant libérer des ions hydroxydes (HO-) en solution aqueuse. Mais cette définition n’était pas assez générale et n’expliquait pas la basicité de certains composés chimiques ne libérant pas de HO- en solution aqueuse.
Acide de Bronsted
Selon la théorie de Brønsted-Lowry, énoncée en 1923, un acide est toute espèce qui peut libérer un ou plusieurs protons, et une base toute espèce qui peut capter un ou plusieurs protons. Les protons ne pouvant exister à l'état libre en solution, la théorie de Brønsted met l'accent sur le couple acide-base :
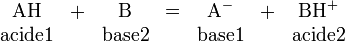
Les réactions qui ont lieu entre un acide et une base sont nommées « réactions acido-basique », ou « réactions acide-base ». Un tel acide est appelé acide de Brønsted.
Dans cette théorie, l'autoprotolyse de l'eau s'interprète comme la réaction de l'acide eau sur la base eau. L'eau est donc un ampholyte.
L'avantage de cette théorie sur la théorie d'Arrhenius est double :
- La théorie justifie que certaines espèces comme l'ammoniac soient basiques
- La théorie ne donne pas d'importance particulière au solvant, on peut donc parler de réaction acido-basique, même en phase gazeuse
Acide de Lewis
La définition de Lewis (1923) est de loin la plus large : un acide de Lewis est accepteur de doublets, ayant donc une orbitale vide, et une base de Lewis est un donneur de doublets, ayant un doublet libre. Par cette définition, un acide est un composé chimique qui peut, au cours d’une réaction, accepter une paire d’électrons (un doublet). C’est donc un composé chimique électrophile, qui possède une lacune électronique dans sa structure.
On peut aisément reconnaitre un acide grâce à des tests de pH. Une solution acide a un pH inférieur à 7, à 25 °C. Plus le pH est bas, plus l’acidité est forte. Pour mesurer le pH, on peut effectuer différents tests : papiers pH, indicateurs colorés, utilisation d’un pH-mètre, feuilles de choux rouge, etc.
Les espèces acides au sens de Bronsted peuvent libérer un ou plusieurs protons on parle alors respectivement de monoacides et de polyacides
Acides dans d’autres solvants
La généralisation de la notion d’acidité a permis d’étendre l’étude à d’autres solvants.
Solvants protiques
Ce sont des solvants capables de céder et capter un ion H+, appelé communément proton (d'où le terme « protique »). Par exemple NH (donne NH- et NH+), HF, CHCOOH, HSO, etc.
Dans ces solvants, la notion de couple acide-base reste centrée sur l’échange de protons et les couples dans ces solvants restent les mêmes que dans l’eau. L’intérêt de ce type de solution vient de la réaction d’autoprotolyse du solvant qui limite la force des acides (et des bases) pouvant exister en solution. On utilisera donc un solvant plus basique que l’eau comme NH pour travailler avec des bases très fortes comme H-CC:- ; et un solvant plus acide comme HSO pour travailler avec des acides forts.
Solvants non protiques
Le transfert particule peut se faire avec autre chose qu’un proton. Dans un solvant comme NO, on a la réaction 2 NO → NO- + NO+ qui peut être vue comme le transfert d’un ion O2- c’est la définition des acides de Lux-Flood. On peut alors définir une base comme un donneur d’ion O2-(riche en électron) et un acide comme un accepteur d’ion O2-. Dans d’autres cas c’est un transfert d’ion F-. Ce type de conception des réaction en solution joue un rôle important en métallurgie et dans l’étude des roches (voir ci-dessous).
Acides en géologie
En géologie, on dit qu’une pierre est acide si elle renferme plus de 65 % de silice. Ceci est une règle qui traduit la définition des acides de Lux-Flood : la silice qui est un accepteur d’ion oxyde O2- est acide.
- SiO + HO = HSiO
Donc les roches riches en silice sont acides, les roches riches en calcaire sont basiques. Cela a une importance pour comprendre le comportement des magmas (notamment dans les volcans), et lorsque l’on veut dissoudre une roche pour l’analyser, par exemple dissolution dans un acide pour analyse par ICP ou bien dissolution dans un verre pour analyse par spectrométrie de fluorescence X (technique dite de la « perle fondue »).
Pour cette dernière application, on estime souvent l’acidité par l’indice d’acidité, qui est le nombre d’atomes d’oxygène divisé par le nombre d’autres atomes ; par exemple, le SiO a un indice d’acidité de 2, le CaCO a un indice d’acidité de 1,5.


















































