Toxine diphtérique - Définition
La liste des auteurs de cet article est disponible ici.
Structure et fonction protéine diphtérique
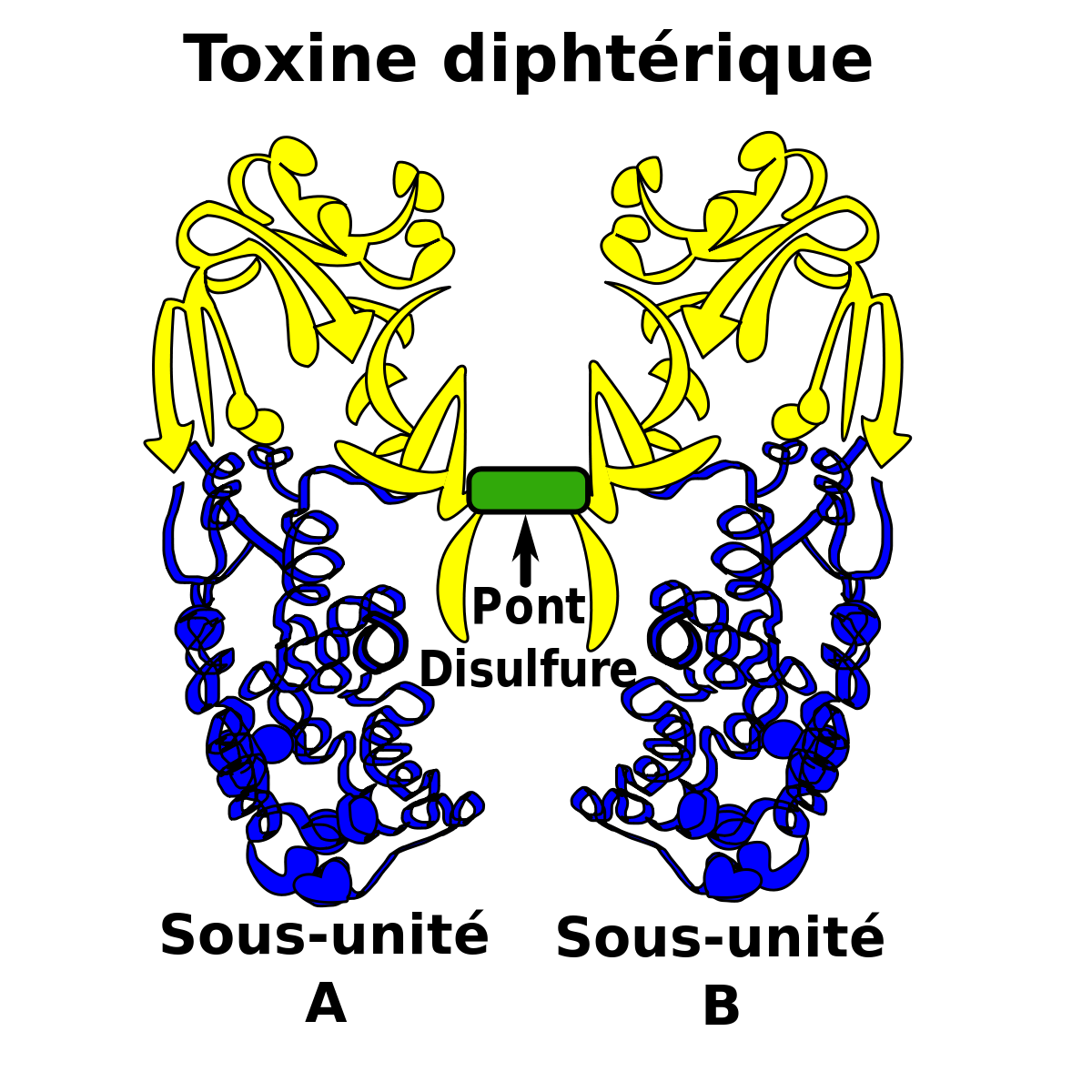
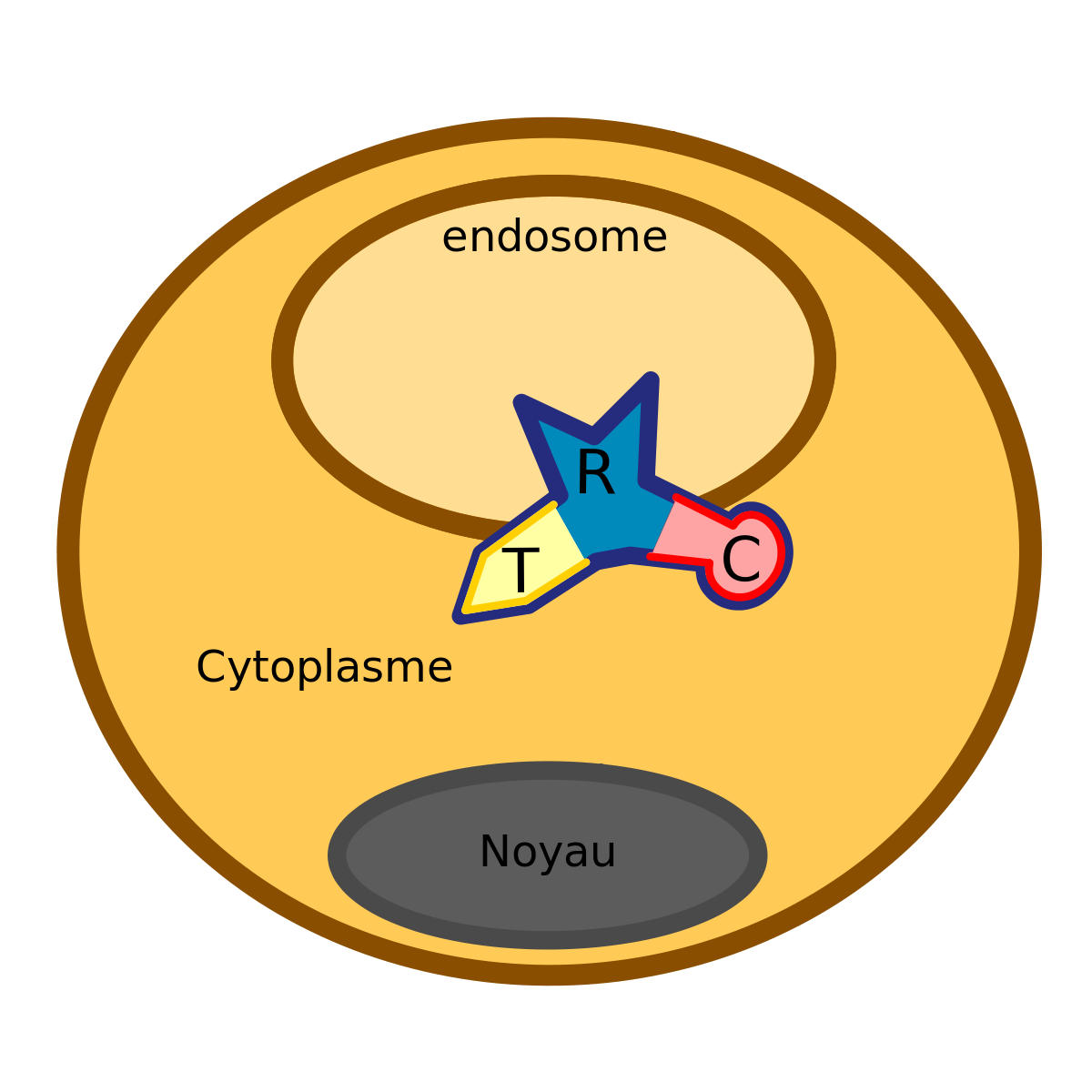
La toxine diphtérique (TD) est une exotoxine protéique de 62 kDa. Lorsque nous analysons le corynebacterium dans la banque de données Protein avec le logiciel Related structures, nous observons clairement trois domaines distincts dans cette pro-enzyme.
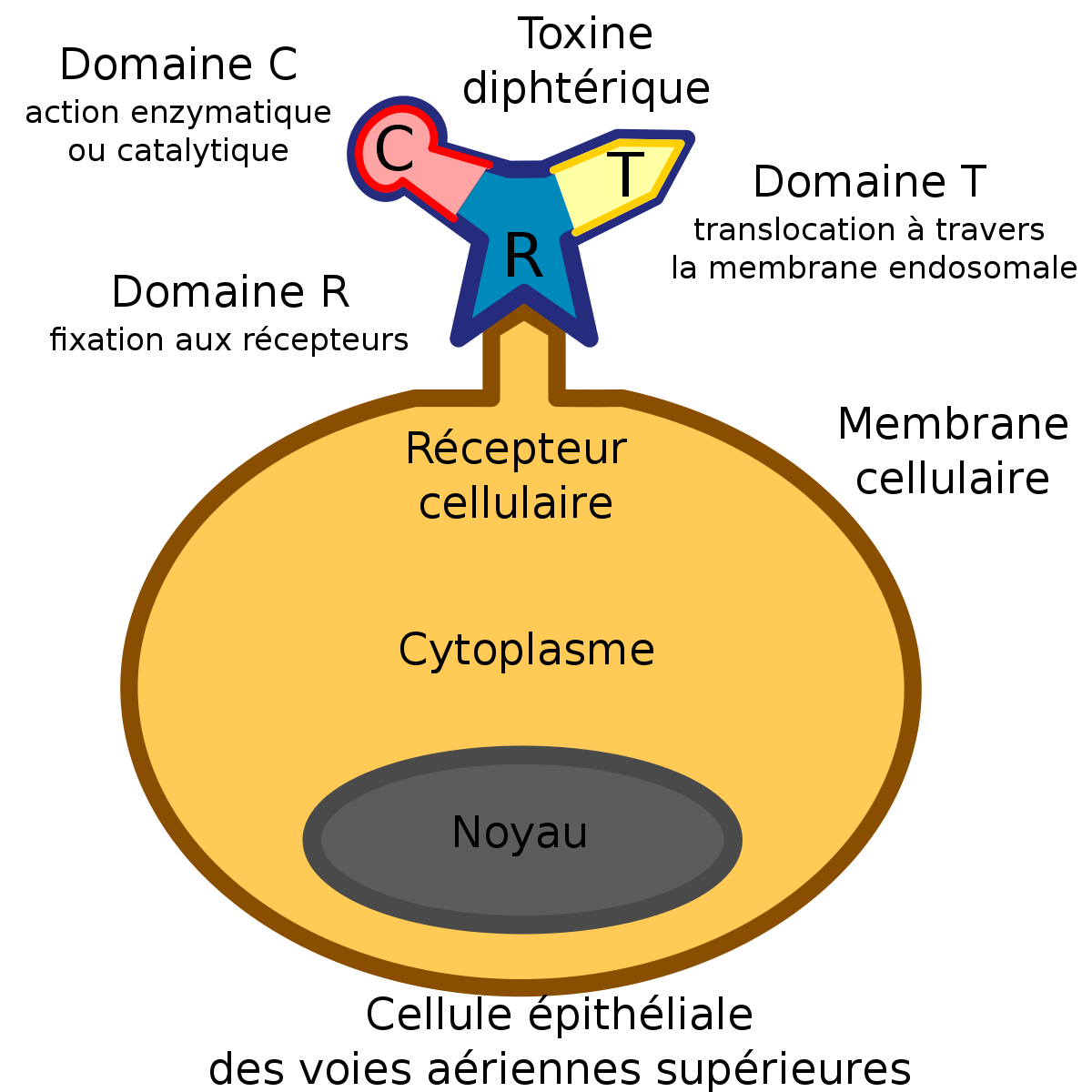
- Chaîne R : qui permet la fixation aux récepteurs
- Chaîne T : qui permet la translocation à travers la membrane endosomale
- Chaîne C : domaine enzymatique ou catalytique
Le domaine R (aussi appelé sous- unité B) est situé à la partie C-terminale de la toxine diphtérique tandis que le domaine C (généralement appelé sous- unité A) est situé vers la partie N-terminale. La raison pour laquelle il y a deux appellations différentes pour les domaines est que la découverte de cette toxine est significativement ultérieure (environ 120 ans plus tôt) à la compréhension du mécanisme d’action de la toxine. Il est en effet plus simple d’expliquer le fonctionnement de la toxine à l’aide de trois domaines actifs contrairement à deux.
Fonctions des différents domaines
Le domaine R
Son rôle essentiel est de s’amarrer à la membrane cellulaire. Pour ce faire il doit se fixer chronologiquement à ces trois molécules
- Le récepteur cellulaire : le pro-HB-EGF (heparin-binding EGF-like growth factor)
- Le co-récepteur CD-9
- HSPG (heparin-sulfate-proteolglycan)
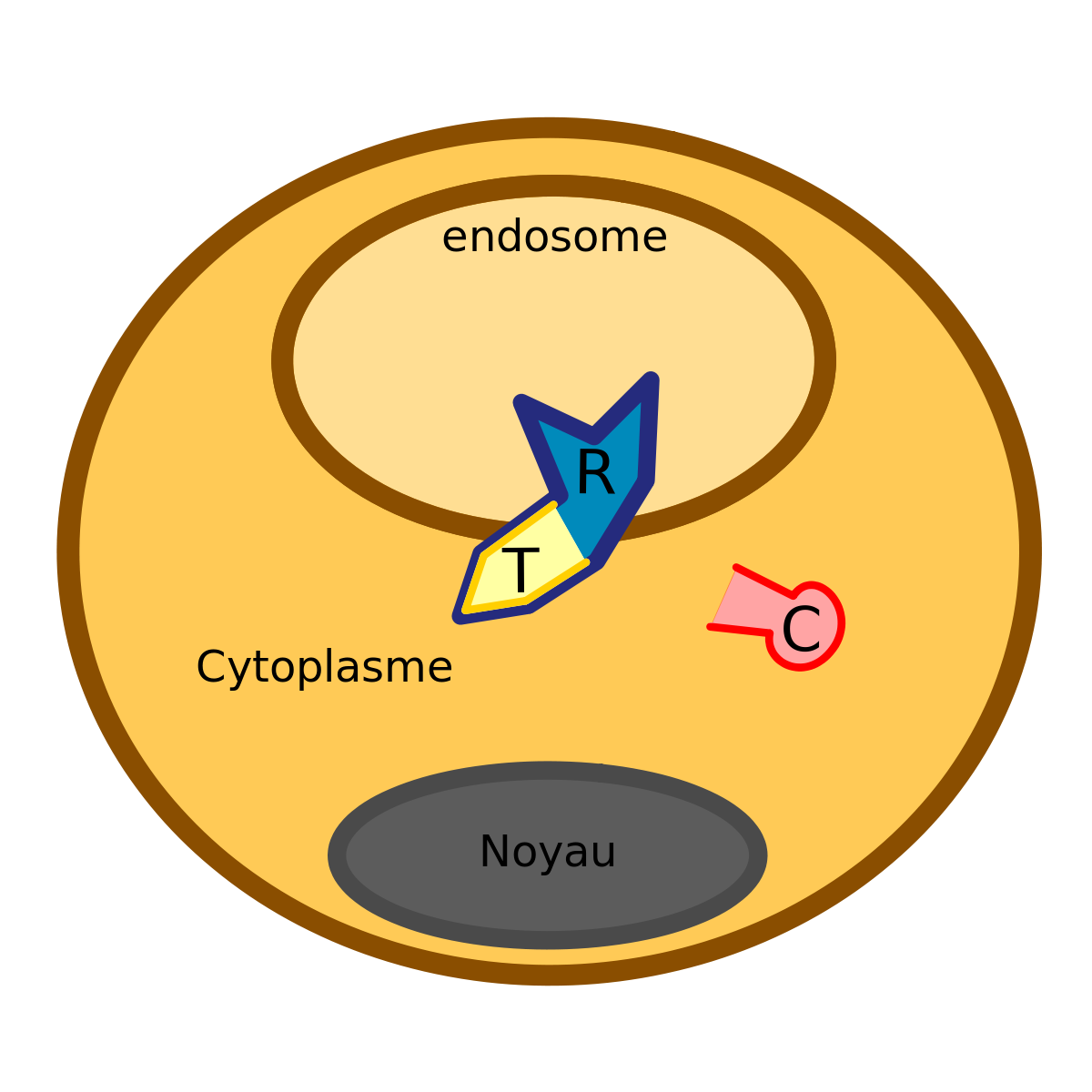
La fixation sur le récepteur cellulaire permet à la furine de cliver la toxine en ses deux sous-unités A (le domaine C) et B (le domaine R).
Les 2 sous-unités restent associées grâce à un pont disulfure. Ce clivage permet l’activation de la toxine diphtérique. Il ne faut pas oublier que c’est uniquement la sous-unité A qui possède l’activité enzymatique.
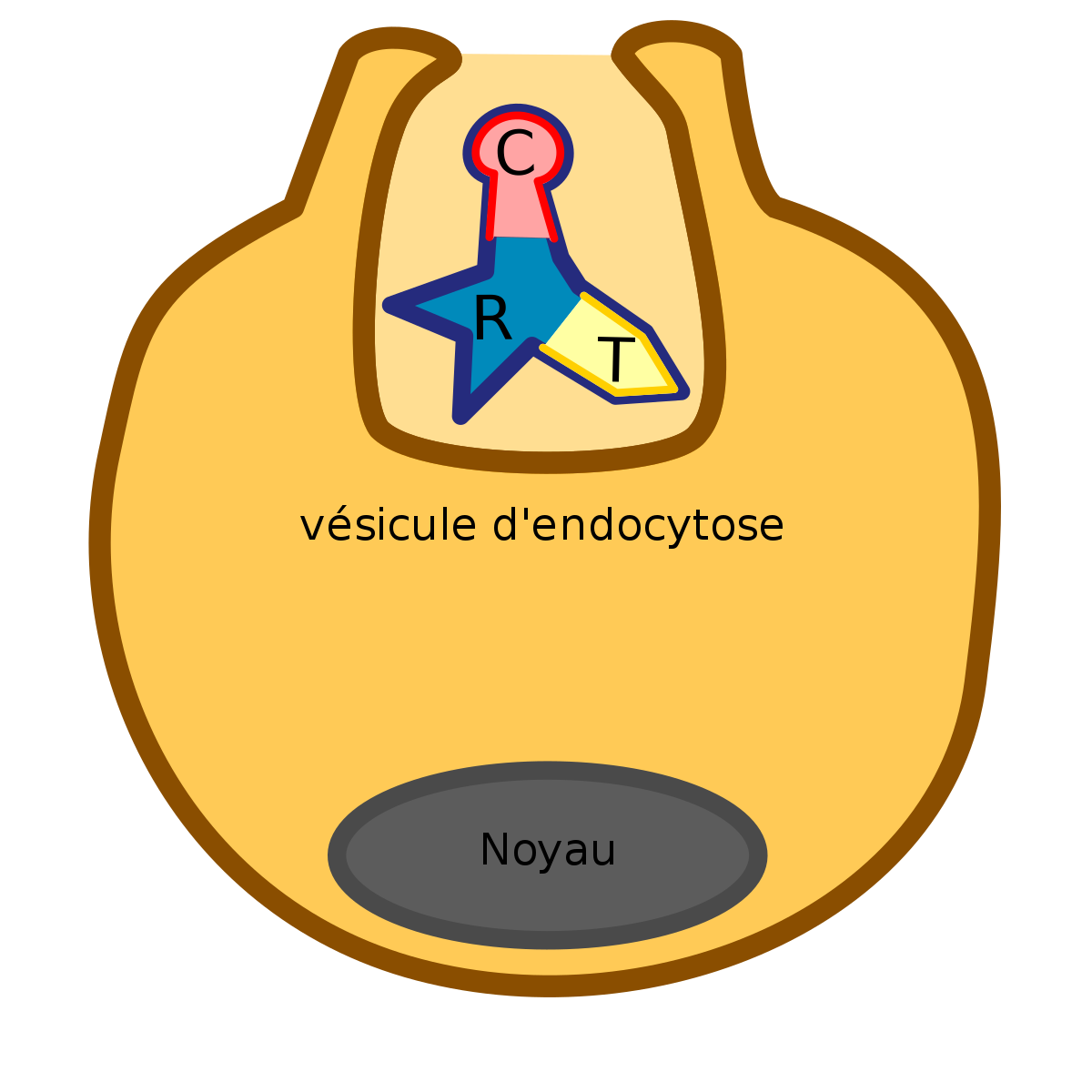
Après interaction avec son récepteur cellulaire, la toxine peut s’introduire dans le récepteur par endocytose.
Le domaine T
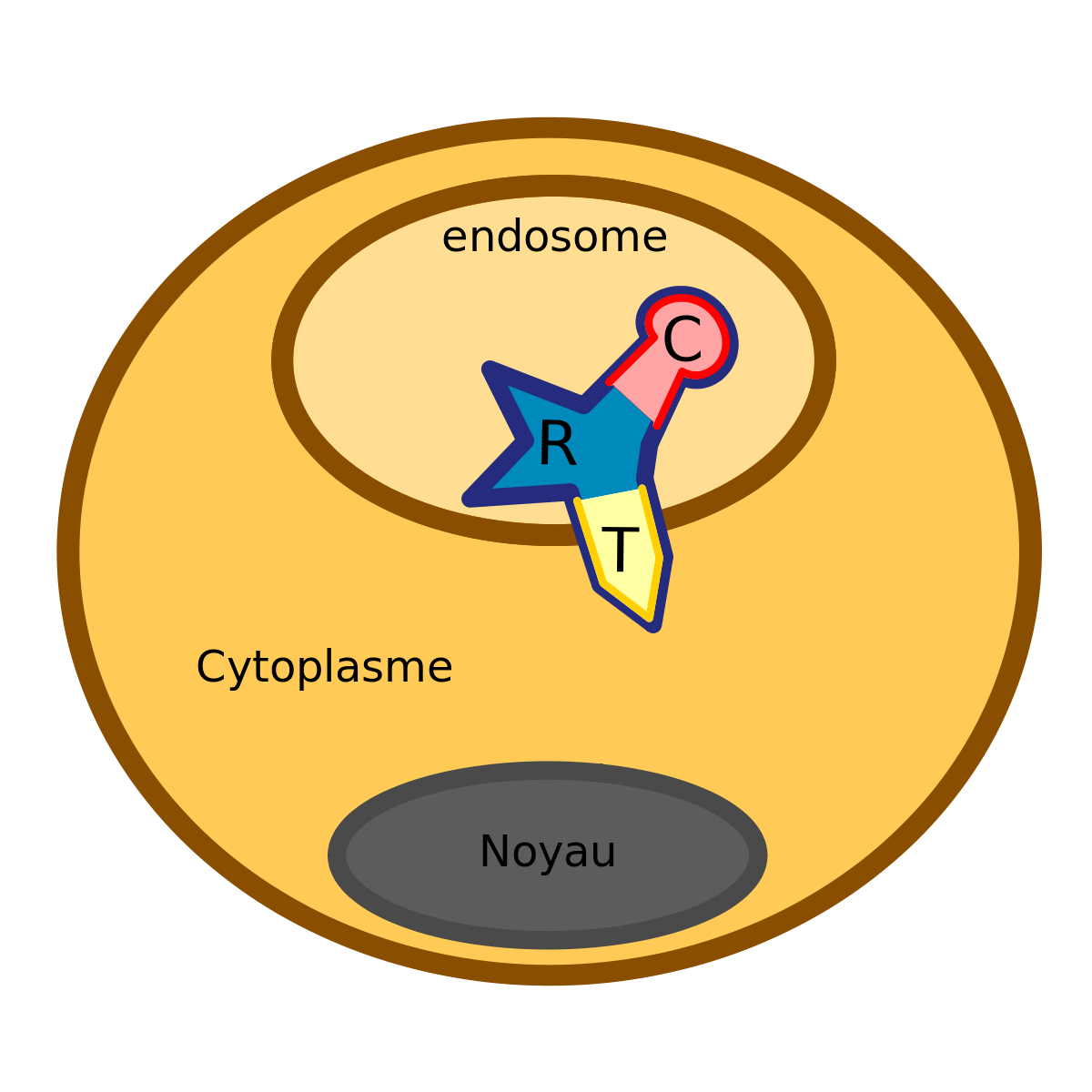
C’est la partie centrale de la toxine diphtérique qui permet une translocation
Son action, sous l’influence d’une baisse du pH de l’endosome, consiste à une translocation de la toxine avec le domaine T au niveau de la membrane de l’endosome. Cela amène comme conséquence la libération du domaine C dans le cytoplasme de la cellule cible.
Le domaine C
C’est la partie active de la toxine diphtérique.
La toxine diphtérique est une ADP ribosyl transférase activement dirigée contre le facteur EF2.
Normalement, la cible de l’ADP-ribosylase est le transfert d’un ADP-ribose d’un NAD+ à un substrat qui au niveau des voies respiratoires supérieures, se concentre sur le facteur EF2. Ce dernier, en présence de GTP, est un des facteurs d’élongation de la synthèse protéique dans les cellules eucaryotes. En résumé, il permet la division cellulaire.
L’inhibition de la synthèse protéique due à l’action de la toxine, est à l’origine de la mort de la cellule, puisqu’elles ne sont plus capables de se diviser.