Acide trichloroacétique - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
| Acide trichloroacétique | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | Acide trichloroéthanoïque | ||
| No CAS | |||
| No EINECS | |||
| Apparence | cristaux incolores et hygroscopiques, d'odeur âcre | ||
| Propriétés chimiques | |||
| Formule brute | C2HCl3O2 | ||
| Masse molaire | 163,387 ± 0,008 g·mol-1 | ||
| pKa | 0,77 | ||
| Moment dipolaire | 3,23 D | ||
| Propriétés physiques | |||
| T° fusion | 58 °C | ||
| T° ébullition | 198 °C | ||
| Solubilité | dans l'eau : très bonne | ||
| Masse volumique | 1,6 g·cm-3 | ||
| Pression de vapeur saturante | à 51 °C : 133 Pa | ||
| Thermochimie | |||
| Cp | 314 J/mol.K | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 35, 50/53, | |||
| Phrases S : (1/2), 26, 36/37/39, 45, 60, 61, | |||
| | |||
| |||
| | |||


Danger | |||
| | |||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme | |||
| Écotoxicologie | |||
| LogP | 1,7 | ||
| Seuil de l’odorat | bas : 0,24 ppm haut : 0,37 ppm | ||
| | |||
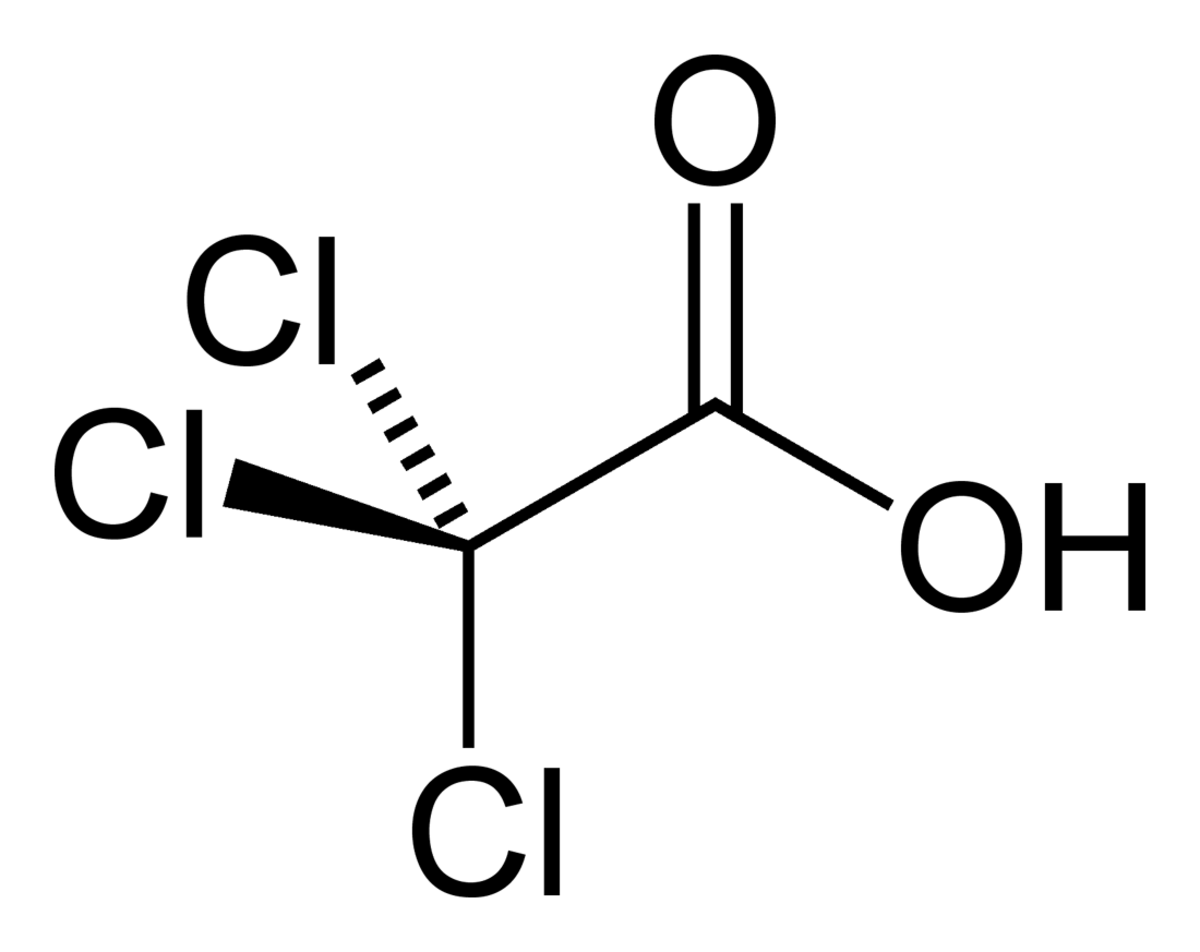
L'acide trichloroacétique est un composé analogue de l'acide acétique dans lequel les trois atomes d'hydrogène du groupe méthyle ont été remplacés par trois atomes de chlore.
C'est un acide fort.
Il est obtenu par réaction du chlore sur l'acide acétique en présence d'un catalyseur.
- CH3COOH + 3Cl2 → CCl3COOH + 3HCl