Diagramme de Frost - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
Exemple simple
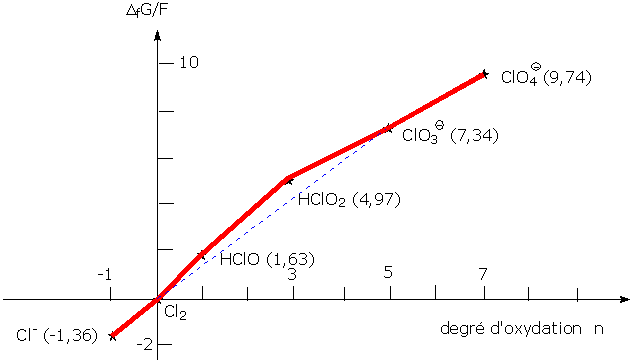
Nous allons tracer le diagramme de Frost du chlore, qui présente 7 degrés d'oxydation principaux :
Voici les espèces présentes à pH = 0
- -1 : Cl- : ion chlorure
- 0 : Cl2 : dichlore
- +1 : HClO : acide hypochloreux
- +3 : HClO2 : acide chloreux
- +5 : ClO3- : ion chlorate
- +7 : ClO4- : ion perchlorate
Les potentiels rédox par un couple X/dichlore (ou inversement s'il s'agit de l'ion chlorure) sont les suivants :
couple redox Potentiel redox standard (volts) Cl2/Cl- 1,36 HClO/Cl2 1,63 HClO2/Cl2 1,66 ClO3-/Cl2 1,47 ClO4-/Cl2 1,39
Les produits (nombre d'oxydation) x (potentiel redox) valent, pour chacun des degrés d'oxydation :
Cl- -1,36 Cl2 0 HClO 1,63 HClO2 4,97 ClO3- 7,34 ClO4- 9,74
Ces produits représentent l'enthalpie libre de formation ΔfG°de chaque structure divisée par F
Cela permet d'obtenir le graphe suivant:
Tracés pour d'autres éléments
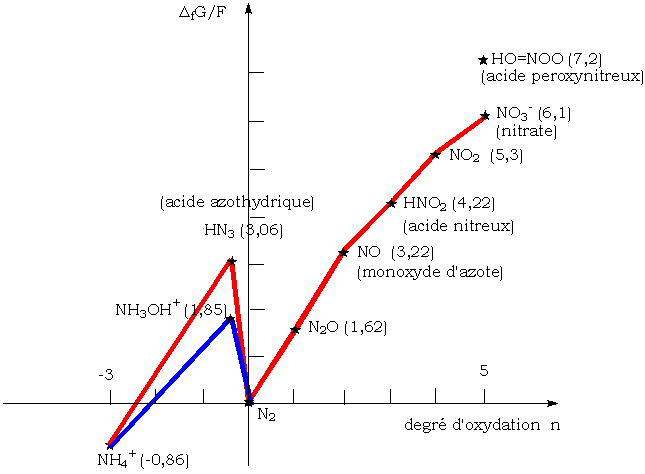
Diagramme de frost de l'azote à pH = 0
Tracé du diagramme à d'autres pH
Grâce à l'Équation de Nernst, on peut déterminer les potentiels rédox standard à un pH quelconque, connaissant les constantes d'acidité des composés mis en jeu.

















































