Dichlore - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Dichlore | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| No E | E925 | ||
| Apparence | gaz jaune-verdatre, d'odeur acre. | ||
| Propriétés chimiques | |||
| Formule brute | Cl2 | ||
| Masse molaire | 70,906 ± 0,004 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | -101 °C | ||
| T° ébullition | -34,6 °C | ||
| Solubilité | 14,6 g·l-1 dans l'eau à 0 °C, 7,3 g·l-1 à 20 °C, 5,7 g·l-1 à 30 °C | ||
| Masse volumique | 2,48 (par rapport à l'air) à 20 °C 6.864atm : 1.4085(liq) à -35 °C 0.9949atm : 1.5649(liq) | ||
| Pression de vapeur saturante | 6,776 bar à 20 °C 8,8 bar à 30 °C 14,3 bar à 50 °C | ||
| Point critique | 143,81 °C 79,914 bar 0,57688 kg·l-1 | ||
| Point triple | -100,98 °C 0,01387 bar | ||
| Thermochimie | |||
| ΔH° | 20,41 kJ·mol-1 (1 atm, -34,04 °C); 17,65 kJ·mol-1 (1 atm, 25 °C) | ||
| Cp | |||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 11,480 ± 0,005 eV (gaz) | ||
| Cristallographie | |||
| symbole de Pearson | oC8 | ||
| Classe cristalline ou groupe d’espace | Cmca (n°64) | ||
| Strukturbericht | A14 | ||
| Structure type | I2 | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 23, 36/37/38, 50, | |||
| Phrases S : (1/2), 9, 45, 61, | |||
| | |||
| |||
| | |||
|
0 4 0 OX | |||
| | |||



| |||
| | |||




Danger | |||
| Inhalation | odeur suffocante | ||
| Écotoxicologie | |||
| CL | 1 heure : rats 293 ppm souris 137 ppm | ||
| Seuil de l’odorat | bas : 0,02 ppm haut : 3,4 ppm | ||
| | |||
Le dichlore (Cl2) est un gaz jaune-vert dans les conditions normales de pression et de température (chloros signifie « vert » en grec). Il est 2,5 fois plus dense que l'air. Il a une odeur suffoquante très désagréable et est extrêmement toxique.
Le dichlore a été découvert par Scheele en 1774. Il a été utilisé lors de la Première Guerre mondiale en tant que gaz de combat, la bertholite.
Le dichlore est soluble dans l'eau formant l'eau de chlore, mais il n'est pas soluble dans l'eau salée.
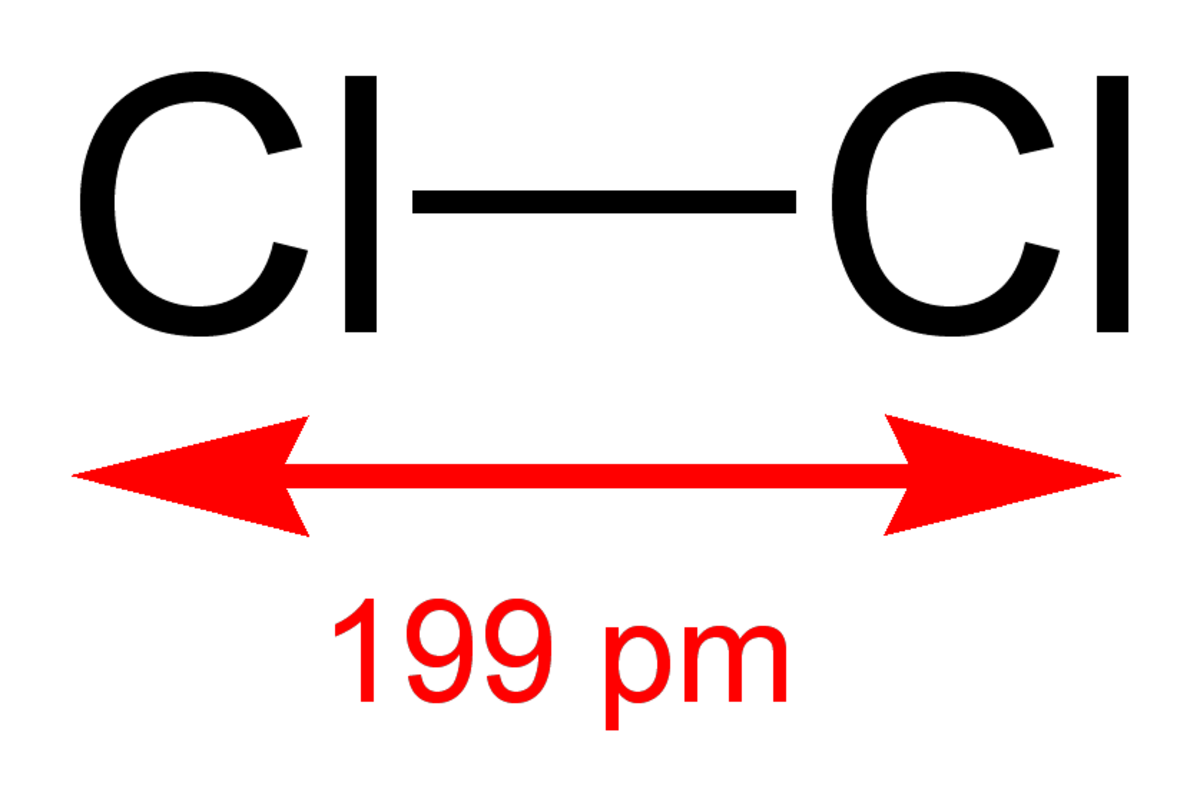
La molécule de dichlore (Cl2) est formée de deux atomes de chlore.
Production
Le dichlore peut être produit facilement en électrolysant une solution de chlorure de sodium.
- 2Na+ + 2Cl- + 2H2O → 2NaOH + Cl2 + H2
Scheele le synthétisa en faisant réagir du dioxyde de manganèse avec de l'acide chlorhydrique.
On peut également en fabriquer de petites quantités grâce à la réaction de l'acide chlorhydrique sur le permanganate de potassium.




















































