Nitrate d'aluminium - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
Introduction
| Nitrate d'aluminium | |||
|---|---|---|---|
| |||
| Général | |||
| No CAS | anhydre nonahydrate | ||
| No EINECS | |||
| Propriétés chimiques | |||
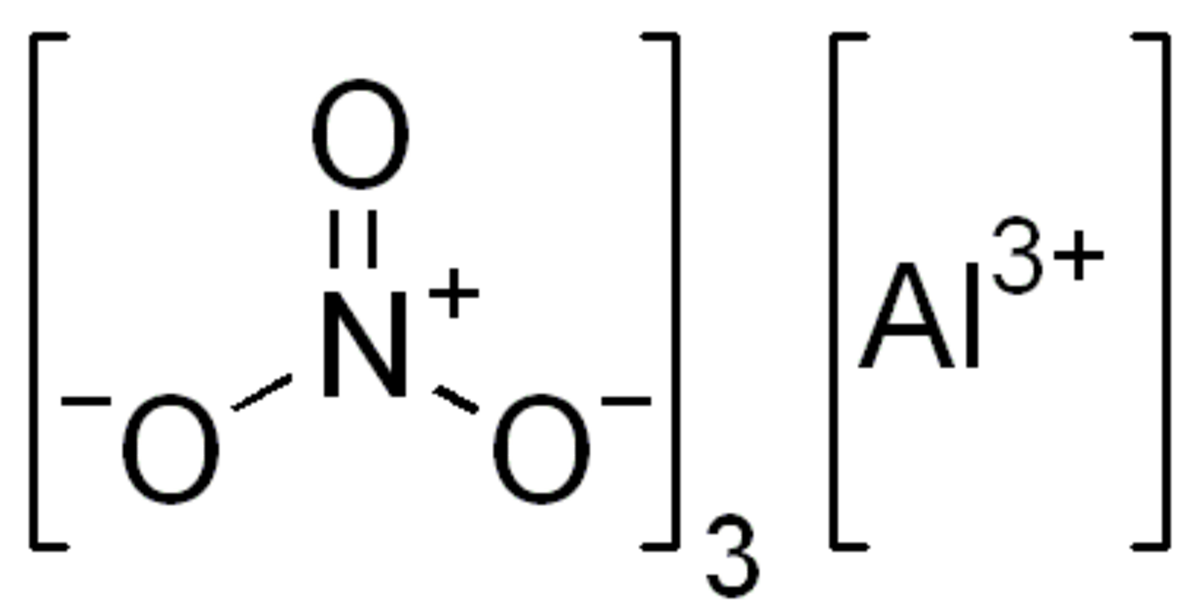
| Formule brute | Al(NO3)3 | ||
| Masse molaire | 212,9962 ± 0,0033 g·mol-1 375.134 (nonahydrate) | ||
| Propriétés physiques | |||
| T° fusion | nonahydrate 73 °C | ||
| T° ébullition | nonahydrate 135 °C | ||
| Masse volumique | nonahydrate 1,72 | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 8, 36/38, | |||
| Phrases S : 17, 26, 36, | |||
| | |||
Nitrate d'aluminium :

Nitrate d'aluminium nonahydraté : 

| |||
| Écotoxicologie | |||
| Seuil de l’odorat | bas : 0,01 ppm | ||
| | |||
Préparation
Le nitrate d'aluminium ne peut être préparé par action de l'acide nitrique sur le métal, car l'aluminium fait de la passivation. Le nitrate d'aluminium peut être préparé par action de l'acide nitrique sur le trioxyde de dialuminium :
Al2O3 + 6HNO3 → 2Al(NO3)3 + 3H2O