Acide nitrique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Acide nitrique | |||||
|---|---|---|---|---|---|
| |||||
| Général | |||||
| Nom IUPAC | |||||
| Synonymes | Acide azotique | ||||
| No CAS | |||||
| No EINECS | |||||
| PubChem | |||||
| ChEBI | |||||
| SMILES | |||||
| InChI | |||||
| Apparence | liquide incolore a jaune, d’odeur acre. (70%), Liquide transparent ou brun | ||||
| Propriétés chimiques | |||||
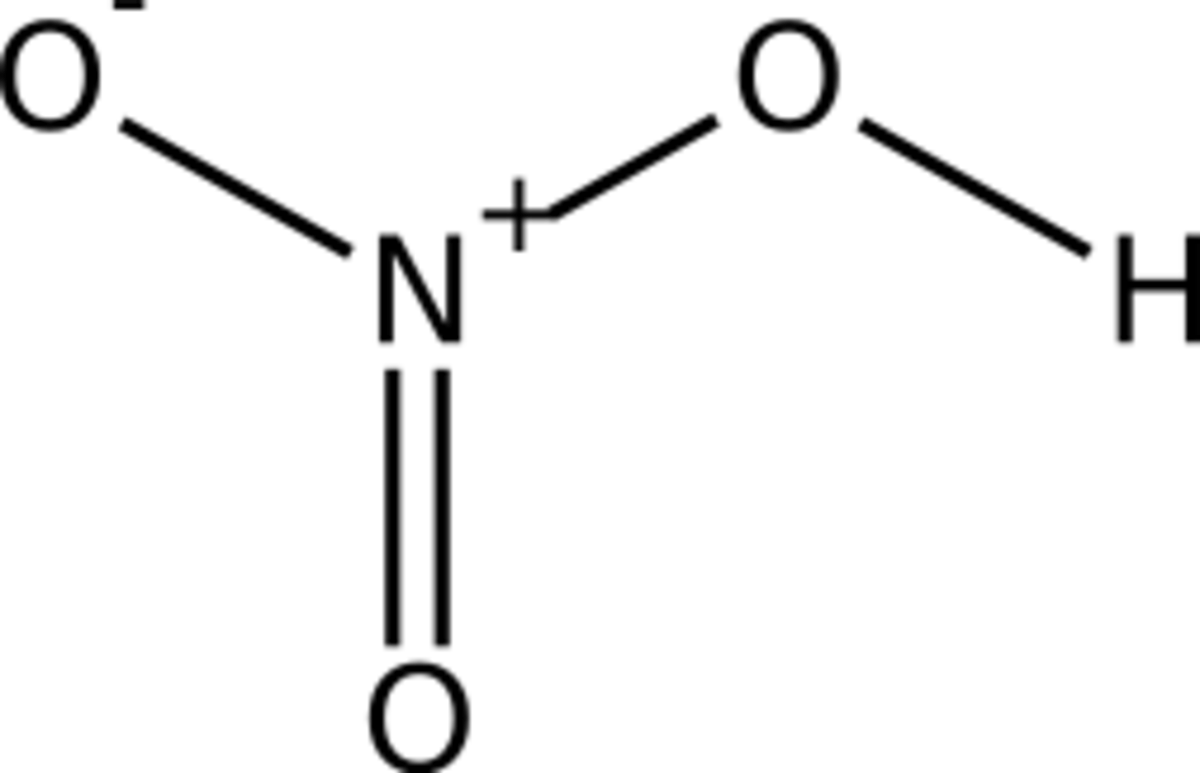
| Formule brute | HNO3 | ||||
| Masse molaire | 63,0128 ± 0,0012 g·mol-1 | ||||
| Moment dipolaire | 2,17 ± 0,02 D | ||||
| Propriétés physiques | |||||
| T° fusion | -41,6 °C (70%) | ||||
| T° ébullition | 121 °C (70%) | ||||
| Solubilité | dans l’eau : miscible | ||||
| Masse volumique | 1,4 g·cm-3 (70%) | ||||
| Pression de vapeur saturante | à 20 °C : 6,4 kPa (70%) | ||||
| Viscosité dynamique | 0,88 mPa·s à 20 °C | ||||
| Thermochimie | |||||
| S0 | 266,39 J/mol⋅K | ||||
| ΔH0 | -174 kJ/mol | ||||
| ΔH° | 39,1 kJ·mol-1 (1 atm, 25 °C) | ||||
| Propriétés électroniques | |||||
| 1re énergie d'ionisation | 11,95 ± 0,01 eV (gaz) | ||||
| Précautions | |||||
| | |||||
| |||||
| Phrases R : 8, 35, | |||||
| Phrases S : (1/2), 23, 26, 36, 45, | |||||
| | |||||
| |||||
| | |||||
| fumant :
0 4 1 OX > 40% :
0 4 0 OX < 40%:
0 3 0 | |||||
| | |||||


| |||||
| | |||||


Danger | |||||
| Inhalation | Très dangereux, les vapeurs peuvent être mortelles | ||||
| Peau | Provoque des brûlures graves | ||||
| Yeux | Provoque des brûlures graves | ||||
| Ingestion | Toxique, provoque des brûlures graves pouvant être mortelles | ||||
| Écotoxicologie | |||||
| Seuil de l’odorat | bas : 0,27 ppm | ||||
| | |||||
L’acide nitrique, parfois appelé acide azotique, est un composé chimique liquide très corrosif de formule chimique HNO3. C’est un acide fort, généralement utilisé en solution aqueuse, communément appelée « eau-forte » par les alchimistes puis les graveurs sur cuivre. Si la concentration est supérieure à 86%, il est baptisé « acide nitrique fumant ». L’acide nitrique est aussi un composant des pluies acides.
Histoire
L’acide nitrique a été synthétisé pour la première fois à la fin du VIIIe siècle par l’alchimiste Jabir Ibn Hayyan qui l’obtint en chauffant du salpêtre KNO3 en présence de sulfate de cuivre (CuSO4⋅5H2O) et d’alun (KAl(SO4)2⋅12H2O). Au XIIIe siècle, Albert le Grand l’utilise pour séparer l’or et l’argent.
Au milieu du XVIIe siècle, Johann Rudolf Glauber obtient l’acide nitrique par distillation du salpêtre en présence d’acide sulfurique, procédé utilisé en laboratoire jusqu’au XXIe siècle. Au cours du XVIIIe siècle, Antoine Lavoisier montre que l’acide nitrique contient à la fois de l’oxygène et de l’azote, la composition précise étant déterminée plus tard par Henry Cavendish.
La fabrication industrielle d’acide nitrique ne prend son essor qu’au cours du XIXe siècle, le salpêtre et l’acide sulfurique étant alors bon marché et disponibles en grandes quantités. En 1838, Frédéric Kuhlmann découvre qu’il est possible de l’obtenir par oxydation de l’ammoniac en présence de platine. Cependant, l’ammoniac nécessaire demeure d’un coût beaucoup trop élevé jusqu’à l’invention du procédé Haber par Fritz Haber en 1909 et de son industrialisation sous la supervision de Carl Bosch de 1909 à 1913 (procédé Haber-Bosch). Wilhelm Ostwald met alors au point le procédé Ostwald qui permet de fabriquer de l’acide nitrique par oxydation de l’ammoniac, procédé qui demeure le plus utilisé au XXIe siècle.




















































