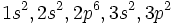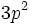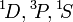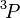Règle de Hund - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
En physique atomique, les règles de Hund se refèrent à un ensemble de règles simples utilisées pour déterminer quel est le terme spectroscopique fondamental de l'atome considéré. Elles furent proposées par Friedrich Hund. En chimie, la première de ces règles est particulièrement importante, et l'on se réfère souvent à elle seule sous le terme de « règle de Hund ».
Les trois règles de Hund sont :
- Pour une configuration électronique donnée, le terme de plus faible énergie est celui maximisant le spin total (
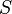
- Pour un spin total donné, le terme de plus faible énergie est celui de plus grande valeur de
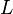
- Pour un terme spectroscopique donné, dans un atome ayant sa couche externe à moitié pleine ou moins, le niveau de plus faible énergie est celui minimisant
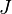
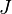
Ces règles montrent comment trouver de manière simple le terme spectroscopique fondamental. Elles supposent que le couplage spin-orbite est négligeable devant la répulsion des électrons de la couche externe, mais qu'il est aussi dominant par rapport à toutes les autres interactions non prises en compte. On parle alors de régime de couplage spin-orbite.
Les orbitales pleines ou les orbitales vides ne contribuent ni au spin total S, ni au moment cinétique orbitalaire total L. On peut montrer que dans ces cas là, le terme électrostatique résiduel (dû à la répulsion électronique) et le couplage spin-orbite, ne peuvent que déplacer en bloc tous les niveaux d'énergie. De ce fait, on ne considère en général que les électrons de valence pour ordonner les niveaux d'énergie.
Règle 1
En raison du principe d'exclusion de Pauli, 2 électrons ne peuvent partager les mêmes nombres quantiques dans le même système. Ainsi, chaque orbitale spatiale ne peut abriter que 2 électrons, de spin opposé (respectivement un spin selon une direction arbitraire Z de
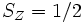
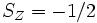
Deux explications physiques ont été offertes (voir Levine p.303-4) pour la stabilité accrue des états de plus haute multiplicité. Aux premier jours de la mécanique quantique, on a proposé que les électrons aux orbitales différentes sont plus éloignés les uns des autres, de sorte que l'énergie de répulsion entre électrons est réduite. Cependant cette explication est maintenant périmée. Des calculs précis basés sur la mécanique quantique à partir des années 1970 démontrent plutôt que les électrons aux orbitales simplement occupés sont moins écrantés vis-à-vis du noyau, de sorte que ces orbitales se rétrécissent et l'énergie d'attraction entre électrons et noyau est augmentée.
Exemple
Considérons l'état fondamental de l'atome de silicium. La configuration électronique de Si est :