Atome - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Un atome (grec ancien ἄτομος [atomos], « que l'on ne peut diviser ») est la plus petite partie d'un corps simple pouvant se combiner chimiquement avec une autre. La théorie atomiste, qui soutient l'idée d'une matière composée de « grains » indivisibles (contre l'idée d'une matière indéfiniment sécable), est connue depuis l'Antiquité, et fut en particulier défendue par Démocrite, philosophe de la Grèce antique. Elle fut disputée jusqu'à la fin du XIXe siècle, mais n'est plus au XXIe siècle l'objet de la moindre controverse. C'est en particulier sur cette notion d'atome que reposent les sciences de la matière modernes. L'atome n'est cependant plus considéré comme un grain de matière insécable, depuis les expériences de physique nucléaire ayant mis à jour sa structure au début du XXe siècle.
Un atome est constitué d'un noyau concentrant plus de 99,9 % de sa masse, autour duquel se distribuent des électrons pour former un nuage 40 000 fois plus étendu que le noyau lui-même. Ce dernier est constitué de protons, chargés positivement, et de neutrons, électriquement neutres ; l'hydrogène fait exception, car le noyau de son isotope 1H, appelé protium, ne contient aucun neutron. Les électrons occupent des orbitales atomiques en interaction avec le noyau via la force électromagnétique, tandis que les nucléons sont maintenus ensemble au sein du noyau par la liaison nucléaire, qui est une manifestation de l'interaction nucléaire forte. Le nuage électronique est stratifié en niveaux d'énergie quantifiés autour du noyau définissant des couches et des sous-couches électroniques ; les nucléons se répartissent également en couches nucléaires, bien qu'un modèle approché assez commode popularise la structure nucléaire d'après le modèle de la goutte liquide.
Plusieurs atomes peuvent établir des liaisons chimiques entre eux grâce à leurs électrons, et, d'une manière générale, les propriétés chimiques des atomes sont déterminées par leur configuration électronique, laquelle découle du nombre de protons de leur noyau. Ce nombre, appelé numéro atomique, définit un élément chimique.
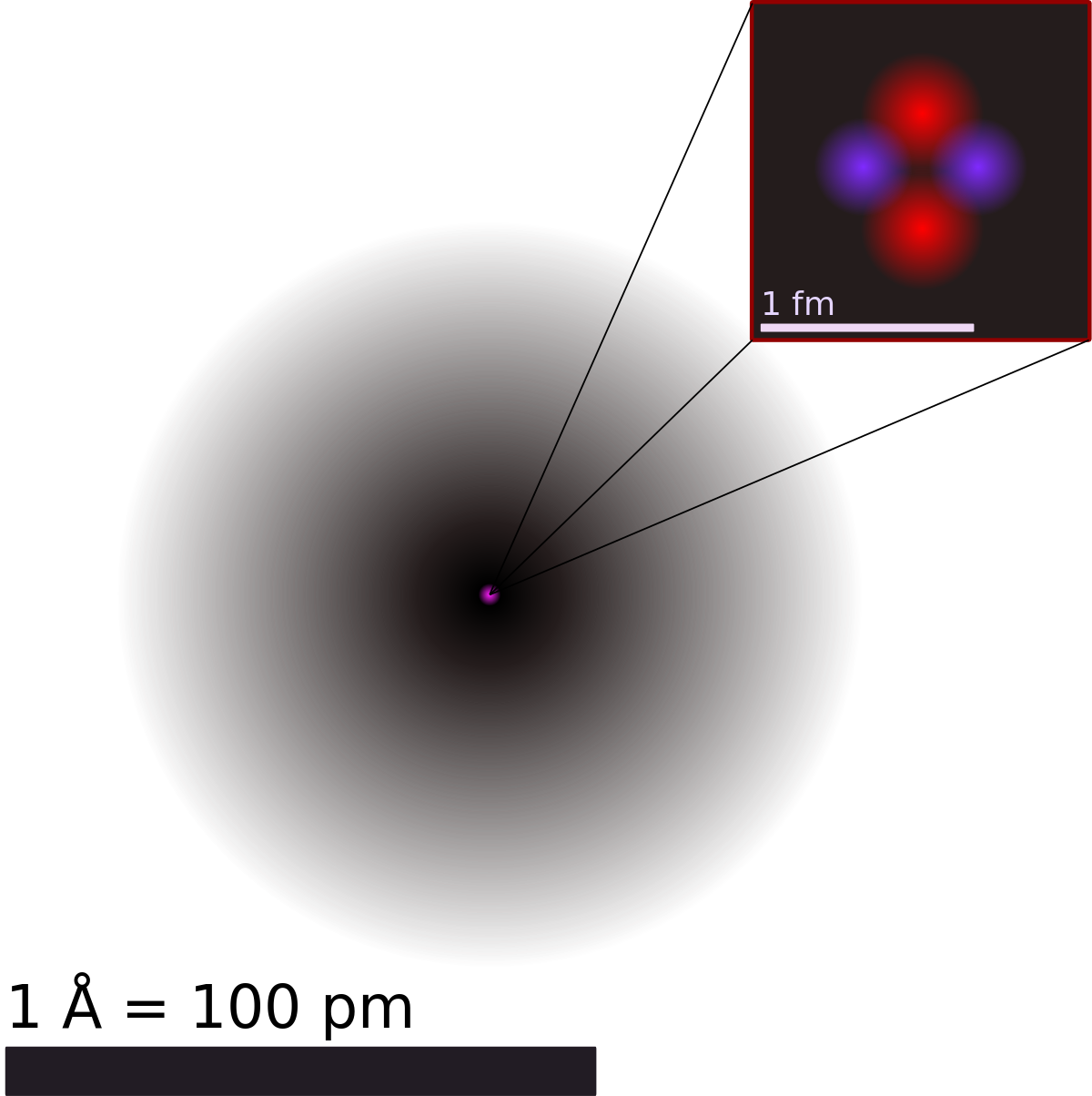
Structure
Ordres de grandeur
Le diamètre estimé d'un atome « libre » (hors liaison covalente ou cristalline) est compris entre 62 pm (6,2×10-11 m) pour l'hélium et 596 pm (5,96×10-10 m) pour le césium, tandis que celui d'un noyau atomique est compris entre 2,4 fm (2,4×10-15 m) pour l'isotope 1H et 14,8 fm (1,48×10-14 m) environ pour le nucléide 238U: le noyau d'un atome d'hydrogène est donc environ 40 000 fois plus petit que l'atome d'hydrogène lui-même.
Le noyau concentre cependant l'essentiel de la masse de l'atome: le noyau du lithium 7, par exemple, est environ 43 000 fois plus massif que les trois électrons qui l'entourent, l'atome de 7Li lui-même ayant une masse de l'ordre de 1,172×10−26 kg. Pour fixer les idées, la masse des atomes est comprise entre 1,674×10-27 kg pour le protium et 3,953×10-25 kg pour l'uranium 238, en s'en tenant aux isotopes qui ont une abondance significative dans le milieu naturel (il existe des noyaux plus lourds mais aussi bien plus instables que le nucléide 238U).
Cette masse est généralement exprimée en unités de masse atomique (« uma », ou « u »), définie comme la douzième partie de la masse d'un atome de 12C non lié et à son état fondamental, soit 1 uma = 1,66054×10-27 kg ; dans cette unité, la masse du nucléide 238U vaut 238,0507826 uma. Une unité alternative également très employée en physique des particules est l'électron-volt divisé par le carré de la vitesse de la lumière (eV/c2), qui est homogène à une masse en vertu de la fameuse équation E = mc 2 de la relativité restreinte, et qui vaut 1 eV/c2 = 1,783×10-36 kg ; dans cette unité, la masse du noyau 238U est égale à 221,7 GeV/c2.
Compte tenu de leur taille et de leur masse singulièrement réduites, les atomes sont toujours en très grand nombre dès qu'on manipule une quantité de matière macroscopique. On définit ainsi la mole comme étant la quantité de matière constituée par autant d'unités élémentaires (atomes, molécules, électrons, etc.) qu'il y a d'atomes dans 12 g de carbone 12, soit pas moins de 6,022×1023 unités élémentaires, ce qu'on appelle le nombre d'Avogadro.
Particules subatomiques
Bien que son étymologie signifie « insécable » en grec ancien, un atome est en réalité constitué de particules élémentaires plus petites, et peut donc étre divisé ; mais il constitue bien la plus petite unité indivisible d'un élément chimique en tant que tel : en brisant, par exemple, un atome d'hélium, on obtiendra des électrons, des protons et des neutrons, mais on n'aura plus un corps simple ayant les propriétés de l'hélium.
-
- L'électron e- est une particule très peu massive (9,1094×10−31 kg, soit 511,00 keV/c2) pourvue d'une charge électrique négative de -1,602×10−19 C.
-
- Le proton p+ est 1 836 fois plus massif que l'électron (1,6726×10−27 kg, soit 938,27 MeV/c2) avec une charge électrique positive de même valeur absolue que celle de l'électron (1,602×10−19 C).
-
- Le neutron n0 est 1 838,5 fois plus massif que l'électron (1,6749×10−27 kg, soit 939,57 MeV/c2), et est électriquement neutre.
Le modèle standard de la physique des particules décrit les nucléons comme des baryons composés de particules élémentaires appelées quarks :
-
- Le proton est constitué de deux quarks up et d'un quark down : p+ = uud.
-
- Le neutron est constitué d'un quark up et de deux quarks down : n0 = udd.
Les électrons, quant à eux, sont des leptons, qui constituent, avec les quarks, le groupe des fermions. La grande différence entre quarks et leptons est que seuls les premiers connaissent toutes les interactions élémentaires, y compris l'interaction nucléaire forte, dont les médiateurs sont des bosons de jauge appelés gluons ; les leptons ne connaissent que l'interaction faible (via les bosons Z0 et W± ) et l'interaction électromagnétique (via les photons).
Toutes ces particules connaissent a priori également l'interaction gravitationnelle, mais cette dernière n'a pas encore pu être intégrée au modèle standard de la physique des particules ; son intensité à l'échelle atomique est, quoi qu'il en soit, insignifiante comparée à l'intensité des trois autres interactions.
Nuage électronique
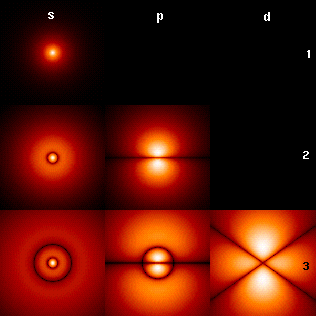
L'essentiel des propriétés physiques et chimiques des atomes est dû à leur nuage électronique. C'est la compréhension de la nature et de la structure de ce nuage électronique qui a ouvert la voie à la compréhension de la structure de l'atome lui-même et, in fine, a conduit au développement de la physique des particules.
Le noyau atomique étant chargé positivement, il forme un puits de potentiel pour les électrons, qui sont chargés négativement. Ce puits de potentiel est constitué de niveaux d'énergie définis par des nombres quantiques dont la combinaison détermine des orbitales atomiques conférant aux fonctions d'onde correspondantes des dimensions et des formes caractéristiques.
Introduction au modèle de Schrödinger
L'électron manifeste, comme tout objet quantique, une dualité onde-corpuscule, en vertu de laquelle il se comporte tantôt comme une particule géométriquement délimitée occupant une position déterminée, tantôt comme une onde susceptible de présenter, par exemple, des phénomènes d'interférences. Ces deux aspects de l'électron coexistent dans l'atome, bien que le modèle de Schrödinger soit exclusivement ondulatoire:
- un électron n'est jamais localisé à un endroit précis d'une trajectoire définie autour de l'atome, mais distribué au sein d'une orbitale atomique avec une probabilité de présence égale au carré de la norme de sa fonction d'onde, laquelle est corrélée à son état quantique, ainsi qu'avec une phase d'électron : c'est l'aspect ondulatoire.
- cette distribution n'est pas statique, mais dynamique, en ce que l'électron est pourvu, au sein de son orbitale atomique stationnaire, d'une quantité de mouvement et d'un moment angulaire orbital : c'est l'aspect corpusculaire.
Par conséquent, un électron ne peut pas « tomber sur le noyau » comme un objet tombe par terre, car cela signifierait que l'extension spatiale de sa fonction d'onde serait réduite à un point, ce qui n'est le cas d'aucune fonction propre de l'équation de Schrödinger : cette dernière impose, au contraire, qu'un électron, au voisinage du noyau, se « dilue » dans un volume (une orbitale) à la géométrie déterminée par les nombres quantiques qui satisfont cette équation. On peut donc considérer qu'un électron dans un atome est déjà tombé sur le noyau, dans la mesure où il est confiné dans son voisinage par le puits de potentiel électrostatique.
De surcroît, la fonction d'onde d'un électron n'est pas nulle à l'intérieur du noyau, bien que sa probabilité de s'y trouver soit faible (le noyau est de taille très réduite comparée à celle des orbitales atomiques). Les fonctions d'ondes possibles pour les électrons d'un atome étant centrées sur le noyau, on peut donc dire que l'électron est en fait tombé dans le noyau, bien qu'il ne s'y trouve que très peu : du point de vue quantique, plusieurs particules peuvent en effet occuper le même espace en vertu de leur nature ondulatoire. Une façon imagée — mais approchée — de voir les choses est d'imaginer, par analogie, que la fonction d'onde de l'électron serait comme « diffractée » par le noyau atomique, ce qui lui donnerait différentes formes, selon son état quantique, par lesquelles la probabilité de présence de l'électron atteindrait son maximum en certaines zones plus ou moins éloignées du noyau — typiquement, plusieurs dizaines de milliers de fois le rayon nucléaire.
Principe d'exclusion de Pauli
Chaque électron est décrit, dans un atome, par un quadruplet de nombres quantiques (n,l,m,s) satisfaisant l'équation de Schrödinger et appelés respectivement :
-
- nombre quantique principal n, définissant les couches électroniques
- nombre quantique secondaire l, définissant les sous-couches électroniques
- nombre quantique magnétique m, définissant l'orientation spatiale de l'orbitale atomique
- nombre quantique de spin s, définissant le moment angulaire intrinsèque de l'électron dans son orbitale
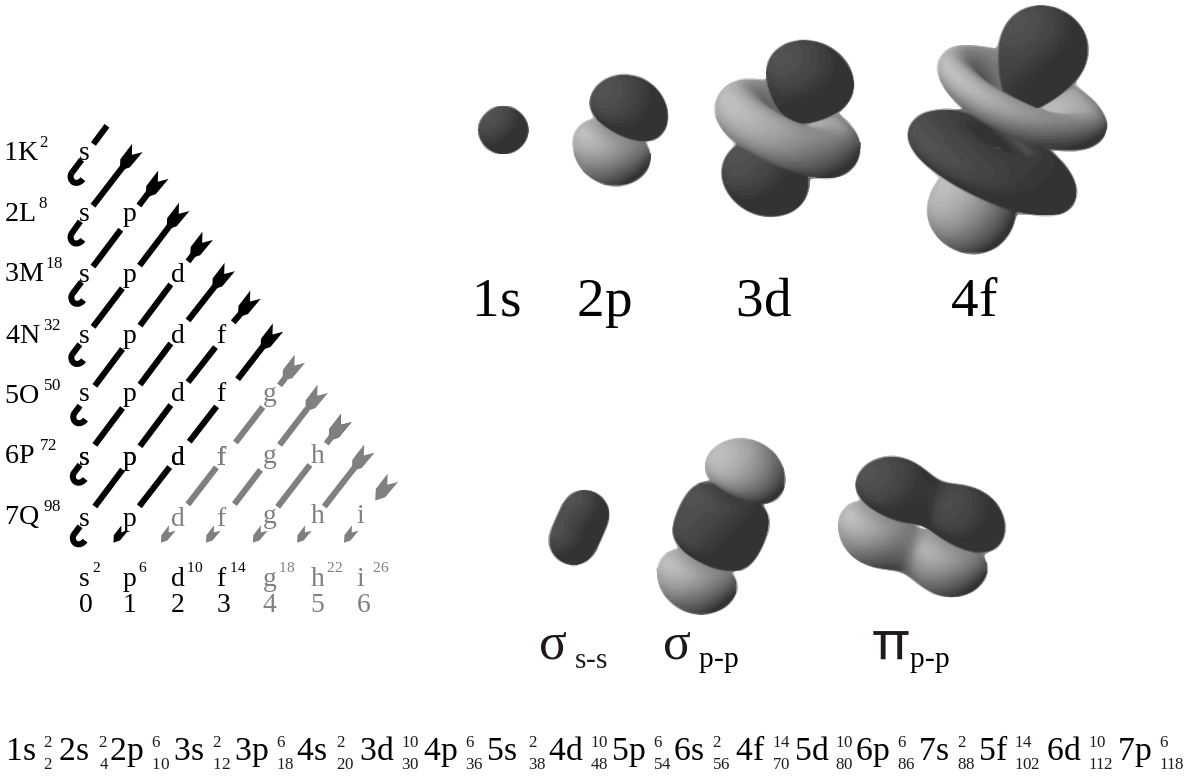
Le principe d'exclusion de Pauli stipule que deux fermions appartenant au même système de fermions (ici, au même atome) ne peuvent avoir tous leurs nombres quantiques égaux en même temps. Ce principe est fondamental car il est à l'origine de la configuration électronique des atomes : les électrons qui « s'empilent » dans l'atome doivent avoir chacun un état quantique distinct des autres, ce qui explique que toutes les orbitales atomiques sont progressivement occupées de la plus liée à la moins liée au noyau au fur et à mesure qu'on ajoute des électrons à l'atome ; c'est le principe d'Aufbau (« édification » en allemand) matérialisé par la règle de Klechkowski, qui sous-tend l'agencement du tableau périodique des éléments chimiques en blocs et en périodes :
-
Sous-couche 1s 1 case quantique → 2 électrons → 2 éléments sur la 1ère période Sous-couche 2s 1 case quantique → 2 électrons Sous-couche 2p 3 cases quantiques → 6 électrons → 8 éléments sur la 2ème période Sous-couche 3s 1 case quantique → 2 électrons Sous-couche 3p 3 cases quantiques → 6 électrons → 8 éléments sur la 3ème période Sous-couche 4s 1 case quantique → 2 électrons Sous-couche 3d 5 cases quantiques → 10 électrons Sous-couche 4p 3 cases quantiques → 6 électrons → 18 éléments sur la 4ème période Sous-couche 5s 1 case quantique → 2 électrons Sous-couche 4d 5 cases quantiques → 10 électrons Sous-couche 5p 3 cases quantiques → 6 électrons → 18 éléments sur la 5ème période Sous-couche 6s 1 case quantique → 2 électrons Sous-couche 4f 7 cases quantiques → 14 électrons Sous-couche 5d 5 cases quantiques → 10 électrons Sous-couche 6p 3 cases quantiques → 6 électrons → 32 éléments sur la 6ème période Sous-couche 7s 1 case quantique → 2 électrons Sous-couche 5f 7 cases quantiques → 14 électrons Sous-couche 6d 5 cases quantiques → 10 électrons Sous-couche 7p 3 cases quantiques → 6 électrons → 32 éléments sur la 7ème période
Orbitales moléculaires
Sa structure électronique confère à l'atome ses propriétés chimiques et magnétiques. Ainsi, les éléments chimiques sont communément classés dans un tableau périodique organisé en fonction de leurs propriétés chimiques et dont l'agencement est en réalité déterminé par la distribution des électrons sur les niveaux d'énergie des atomes.
Le recouvrement de deux orbitales atomiques appartenant chacune à un atome distinct peut conduire à la formation d'une orbitale moléculaire constituant une liaison chimique entre deux atomes ; si les orbitales atomiques en recouvrement appartiennent au même atome, on dit qu'il y a hybridation.
Une orbitale moléculaire est dite liante lorsque les phases d'électron des orbitales atomiques sont de même signe (interférence constructive) ; elle est dite antiliante lorsque les orbitales atomiques ont des phases de signe opposé (interférence destructive).
Noyau atomique
Protons et neutrons forment un noyau atomique de dimension femtométrique. Le rayon nucléaire d'un atome dont le nombre de masse est A vaut environ
![\begin{smallmatrix}1,2\sqrt[3]{A}\end{smallmatrix}](https://static.techno-science.net/illustration/Definitions/autres/1/12c8282f334f1fa062329d1ae4911ffa_6dde92419970107dc90c8726836a2a26.png)
La géométrie des noyaux atomiques est généralement sphérique, bien que certains noyaux stables suffisamment massifs adoptent également des formes sphéroïdes étirées en ballon de rugby ou, au contraire, aplaties. Certains noyaux instables, dits noyaux à halo, sont caractérisés par un ou plusieurs nucléons aux fonctions d'ondes très distendues, qui donnent au noyau des contours flous et un volume apparent très augmenté ; ces noyaux ont une cohésion nucléaire à la limite extrême du champ d'action de l'interaction forte.
Dans le modèle de la goutte liquide, les protons tendent à se repousser les uns les autres et, par conséquent, à se concentrer vers l'extérieur des noyaux (aux « pôles » ou à l'« équateur » dans le cas de sphéroïdes), tandis que les neutrons tendent à s'accumuler au centre du noyau. Des dizaines de modèles ont été proposés afin d'expliquer les données expérimentales sur la nature et la structure des noyaux atomiques, mais aucun, à ce jour, ne suffit seul à rendre compte de l'ensemble des observations.
Le volume nucléaire, estimé expérimentalement par des techniques de diffraction de faisceaux d'électrons, correspond à peu près à l'empilement de sphères dures représentant les nucléons, avec une densité nucléaire constante, ce qui se conceptualise très bien avec le modèle de la goutte liquide. Néanmoins, certaines propriétés quantiques de la structure nucléaire semblent mieux décrites par le modèle en couches, élaboré par les physiciens allemands Maria Goeppert-Mayer et Hans Daniel Jensen, qui ont obtenu le prix Nobel de physique en 1963 pour cette avancée. Leur modèle considère les nucléons comme des fermions soumis au principe d'exclusion de Pauli et répartis sur des niveaux d'énergie quantifiés — les « couches nucléaires » — de façon similaire aux électrons à l'échelle de l'atome. Dans le noyau, protons et neutrons constituent deux populations de fermions distinctes vis-à-vis du principe d'exclusion de Pauli.
L'analogie avec les électrons a cependant ses limites, car, si les électrons interagissent entre eux et avec le noyau via l'interaction électromagnétique, les nucléons interagissent entre eux essentiellement via l'interaction nucléaire forte et l'interaction faible. Les niveaux d'énergie au sein du noyau ont ainsi une distribution différente de celle des niveaux d'énergie des électrons d'un atome. De plus, les phénomènes de couplage spin-orbite sont bien plus sensibles pour les nucléons que pour les électrons, ce qui redistribue les sous-couches nucléaires en fonction du spin (indiqué en indice dans le tableau ci-dessous):
-
Sous-couche 1s 1/2 2 états → 1re couche : nombre magique = 2 Sous-couche 1p 3/2 4 états Sous-couche 1p 1/2 2 états → 2e couche : nombre magique = 8 Sous-couche 1d 5/2 6 états Sous-couche 2s 1/2 2 états Sous-couche 1d 3/2 4 états → 3e couche : nombre magique = 20 Sous-couche 1f 7/2 8 états → 4e couche : nombre magique = 28 Sous-couche 1p 3/2 4 états Sous-couche 1f 5/2 6 états Sous-couche 2p 1/2 2 états Sous-couche 1g 9/2 10 états → 5e couche : nombre magique = 50 Sous-couche 1g 7/2 8 états Sous-couche 2d 5/2 6 états Sous-couche 2d 3/2 4 états Sous-couche 3s 1/2 2 états Sous-couche 1h 11/2 12 états → 6e couche : nombre magique = 82 Sous-couche 1h 9/2 10 états Sous-couche 2f 7/2 8 états Sous-couche 2f 5/2 6 états Sous-couche 3p 3/2 4 états Sous-couche 3p 1/2 2 états Sous-couche 1i 13/2 14 états → 7e couche : nombre magique = 126 Sous-couche 2g 9/2 10 états Sous-couche 3d 5/2 6 états Sous-couche 1i 11/2 12 états Sous-couche 2g 7/2 8 états Sous-couche 4s 1/2 2 états Sous-couche 3d 3/2 4 états Sous-couche 1j 15/2 16 états → 8e couche : nombre magique = 184
La saturation d'une couche nucléaire confère au noyau atomique une stabilité supérieure à celle calculée par la formule de Weizsäcker, issue du modèle de la goutte liquide — ce qui n'est pas sans rappeler l'inertie chimique des gaz rares, caractérisés par la saturation de leur sous-couche électronique p périphérique. Le nombre de nucléons d'une population donnée correspondant à la saturation d'une couche nucléaire est appelé « nombre magique » ; le noyau du plomb 208, qui est le plus lourd des isotopes stables, est ainsi constitué de 82 protons et 126 neutrons : 82 et 126 sont deux nombres magiques, ce qui explique la stabilité de ce nucléide par rapport à ceux qui n'en diffèrent que d'un ou deux nucléons.