Alfred Werner - Définition
La liste des auteurs de cet article est disponible ici.
Introduction

Alfred Werner (12 décembre 1866 à Mulhouse, Haut-Rhin - 15 novembre 1919) est un chimiste suisse. Il est lauréat du prix Nobel de chimie de 1913 pour, entre autres, des travaux en chimie inorganique. Il fut le premier à recevoir un prix Nobel pour des travaux en chimie inorganique, et le seul jusqu’à 1973.
Biographie
Il étudie la chimie, avant d'entrer à l'École polytechnique de Zurich, où il passe son doctorat en 1890. Après un séjour postdoctoral à Paris, il retourne à Zurich pour enseigner dès 1892, et devient professeur ainsi que citoyen suisse en 1895.
Il a reçu le prix Nobel de chimie en 1913 pour avoir expliqué les structures des complexes des métaux de transition dont certains possèdent une configuration octaédrique. Plus précisément, « en reconnaissance de son travail sur le lien entre les atomes dans les molécules grâce à lequel il a jeté un nouvel éclairage sur des recherches antérieures et a ouvert de nouveaux champs de recherche, spécialement en chimie organique ».
Travaux autour de la nature de valence
Avant Werner, les chimistes définissaient la valence d’un élément comme le nombre de liaisons formés par lui, sans distinguer les divers types de liaison. Aux complexes comme le [Co(NH3)6]Cl3 par exemple, Werner a distingué entre les liaisons Co—Cl qui constituent selon lui une valence primaire de 3 à longue distance, et les liaisons Co—N qui font une valence secondaire de 6 à plus courte distance. Après la découverte de l’électron, les idées de Werner ont aidé G.N. Lewis a formuler ses théories sur la nature électronique de la liaison chimique.
Au XXIe siècle, la valence primaire de Werner correspond à l'état d'oxydation, tandis que sa valence secondaire correspond à la coordinence ou nombre de voisins de l’atome central. Les liaisons Co—Cl sont maintenant classées comme ioniques, et chaque liaison Co—N comme une liaison de coordinence entre un acide de Lewis (Co3+) et une base de Lewis (NH3).
Travaux en chimie de coordination
Vers 1893, Werner était le premier à bien formuler les structures des composés de coordination contenant des ions complexes, auquel un atome central d’un métal de transition est entouré par des ligands neutres ou ioniques.
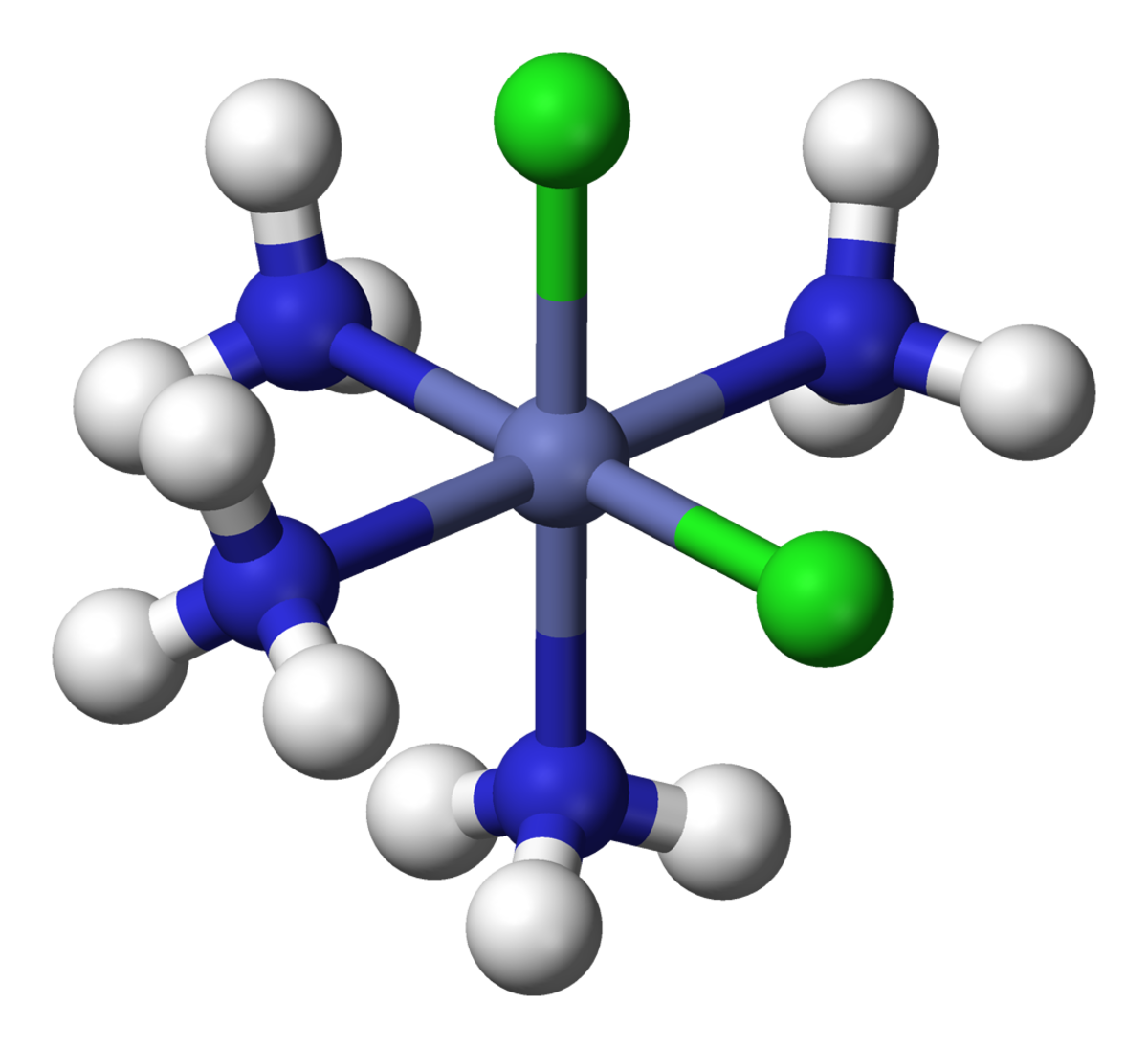
Par exemple, il était déjà connu que le cobalt(III) peut former un « complexe » CoCl3•6NH3, mais la nature de l’association indiquée par le point était mystérieuse. Werner proposa la structure [Co(NH3)6]Cl3, avec le Co3+ entouré par 6 NH3 aux 6 sommets d’un octaèdre. Les 3 Cl- sont des ions dissociés, ce qui fut confirmé par mesure de la conductivité électrique en solution aqueuse.
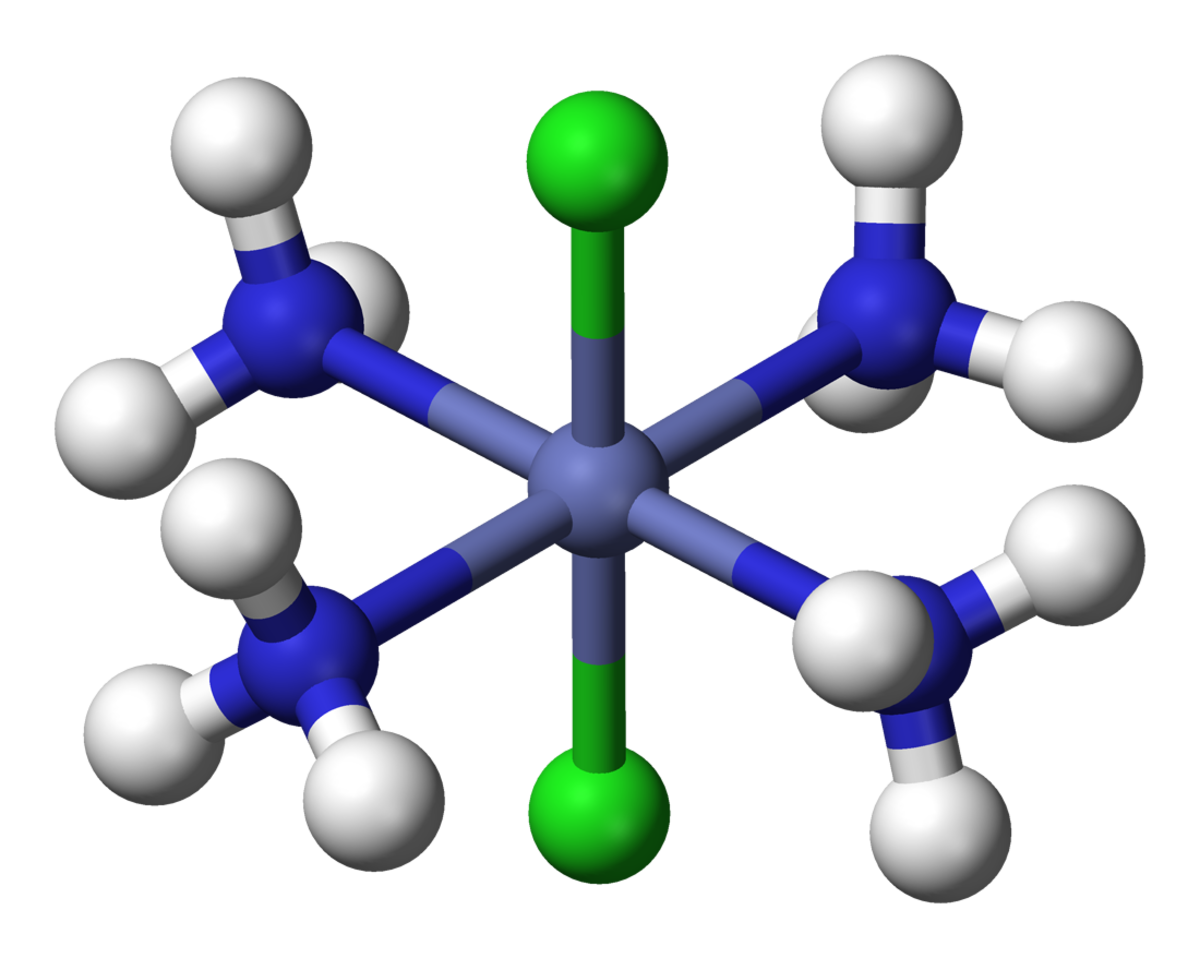
Pour d’autres composés, Werner a réussi à expliquer les nombres d’isomères observés. Par exemple CoCl3 peut aussi réagir avec 4 molécules de NH3 pour former deux composés différents, de couleurs verte et violette. Selon Werner ce sont deux 2 isomères géométriques [Co(NH3)4Cl2]Cl. L’atome de Co est entouré par 4 NH3 et 2 Cl aux sommets d’un octaèdre. L’isomère vert est « trans », avec les 2 Cl aux sommets opposés, et l’isomère violet est « cis », avec les 2 Cl aux sommets voisins.
Avec des ligands bidentés tels que l'éthylènediamine Werner a préparé des isomères optiques, et en 1914 il prépare le premier composé chiral sans le carbone, à savoir l'« hexol » de formule [Co(Co(NH3)4(OH)2)3]Br6. Le fait que des complexes métalliques puissent avoir des isomères optiques a été perçu comme une preuve indiscutable de leur nature octaédrique. En effet, les autres formes qui étaient envisagées, à savoir le prisme trigonal et l'hexagone ne donnent pas une paire d'énantiomères lors de la liaison de 3 ligands bidentés.