Aminoside - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Les aminosides ou aminoglycosides constituent une famille d'antibiotiques actifs sur certains types de bactéries. Ils comprennent l'amikacine, la gentamicine, la kanamycine, la néomycine, la nétilmicine, la paromomycine, la streptomycine (le plus connu, découvert par Selman Waksman), et la tobramycine. La plupart de ces antibiotiques sont produits par des bactéries de la famille des actinomycètes, ou en sont dérivés par hémisynthèse. Ceux qui sont dérivés des actinomycètes du genre Streptomyces prennent le suffixe -mycine, ceux qui sont dérivés du genre Micromonospora prennent le suffixe -micine.
Structure chimique

Les aminoglycosides sont composés de deux à cinq unités de sucres (glucide) substitués par des fonctions amine (-NH2), ce qui constitue l'origine de leur dénomination (amino → amine, glycoside → sucre). La plupart d'entre eux sont construits autour d'un noyau central commun, constitué de 2-désoxystreptamine et de glucosamine (voir figure). Cette structure minimale correspond à l'antibiotique néamine ou néomycine A. La plupart des aminosides utilisés en clinique comportent d'autres sucres aminés, substitués soit en position 4, soit en position 5 du cycle désoxystreptamine. On a ainsi deux familles d'aminosides :
- Les aminosides 4,6 disubstitués, tels que la kanamycine, la gentamicine ou l'amikacine
- Les aminosides 4,5 disubstitués, tels que la néomycine ou la ribostamycine.
Mécanisme d'action
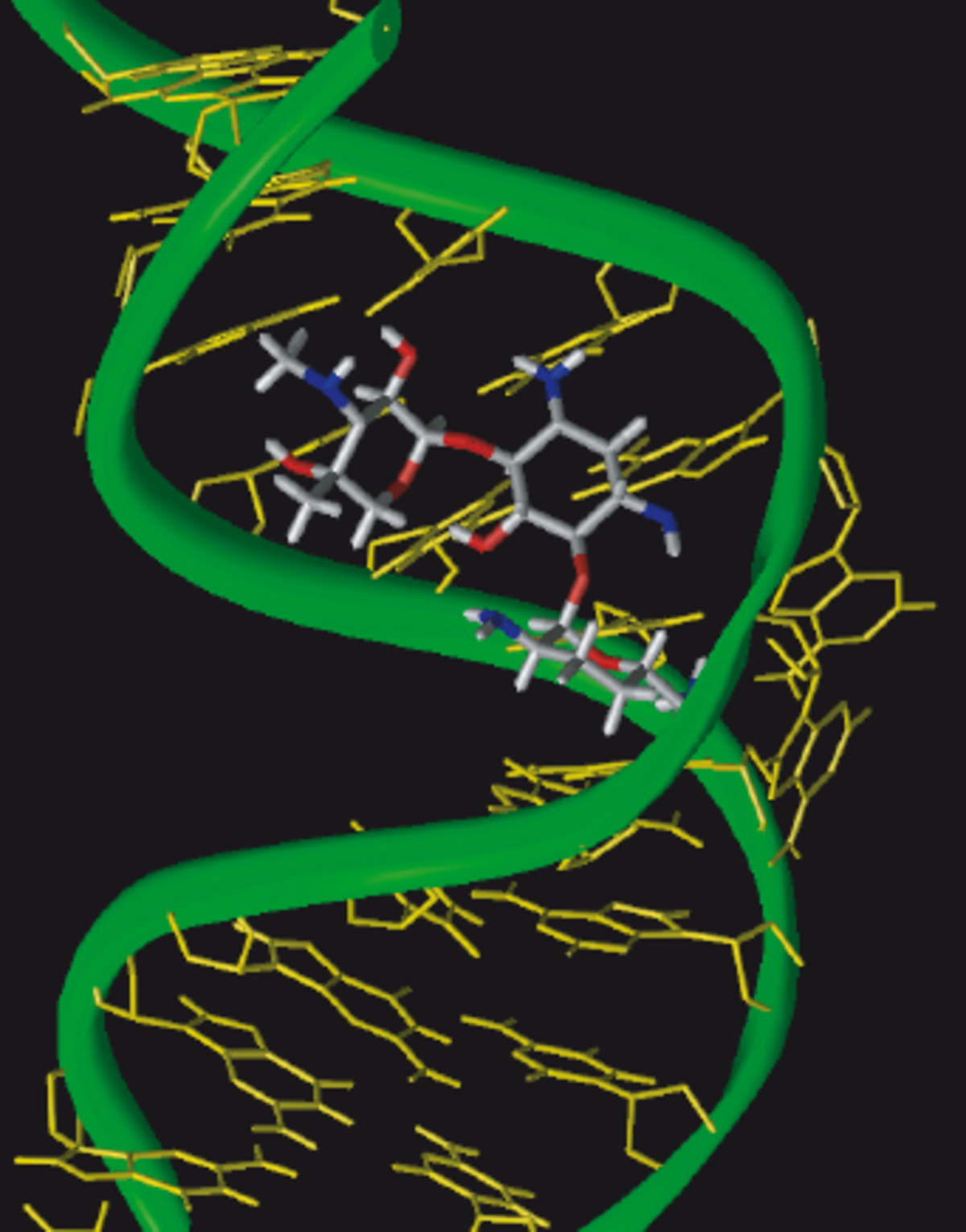
Les aminosides se lient à la sous-unité 30S des ribosomes des bactéries et interfèrent avec la traduction des ARN messagers en protéines. Plus précisément, la plupart des aminoglycosides se fixent à l'ARN ribosomique 16S, au niveau du site de décodage (site A). Cette fixation ne bloque pas la traduction, mais induit des erreurs dans le décodage des codons effectués par le ribosome. C'est l'accumulation des erreurs dans les protéines synthétisées qui est responsable de la létalité induite par les aminosides, par l'accumulation de protéines aberrantes.
Synthèse
La plupart des aminoglycosides sont des produits naturels, produits par des bactéries de la famille des actinomycètes. Un certain nombre de molécules actuellement utilisées en clinique sont produites par hémisynthèse à partir d'un antibiotique naturel de première génération, c'est le cas par exemple de l'amikacine qui est une forme alkylée de la kanamycine où l'unes des deux fonctions amines de la désoxystreptamine est modifiée chimiquement. Cette modification a pour conséquence de permettre à l'amikacine d'échapper à un certain nombre de mécanismes de résistance.
La biosynthèse du noyau central de 2-désoxystreptamine s'effectue en plusieurs étapes à partir du glucose-6-phosphate. Puis différents sucres sont ajoutés par des glycosyltransférases. Les amines sont introduites par l'action successive de réductases et aminotransférases. En tout, plus d'une vingtaine de gènes participent à la synthèse.
Métabolisme
- Les aminosides sont peu ou pas résorbés par l'intestin; dans les infections systémiques, ils devront être administrés par voie parentérale.
- Ils pénètrent difficilement dans la bile et dans le liquide céphalorachidien mais traversent bien le placenta.
- Ils sont peu ou pas métabolisés et sont éliminés par filtration glomérulaire.

















































