Bis(triméthylsilyl)amidure de sodium - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Bis(triméthylsilyl)amidure de sodium | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | hexaméthyldisilazoture de sodium NaHMDS | ||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | solide blanc cassé | ||
| Propriétés chimiques | |||
| Formule brute | C6H18NNaSi2 | ||
| Masse molaire | 183,3746 ± 0,0069 g·mol-1 | ||
| pKa | pka de l'acide conjugué : 26 (in THF), 30 in DMSO) | ||
| Propriétés physiques | |||
| T° fusion | 171-175 °C | ||
| T° ébullition | 170 °C à 2 mmHg | ||
| Solubilité | réagit avec l'eau, soluble dans THF, benzène ou toluène | ||
| Masse volumique | 0,9 g·cm-3 (solide) | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 11, 15, 34, 35, | |||
| Phrases S : 16, 24/25, | |||
| | |||
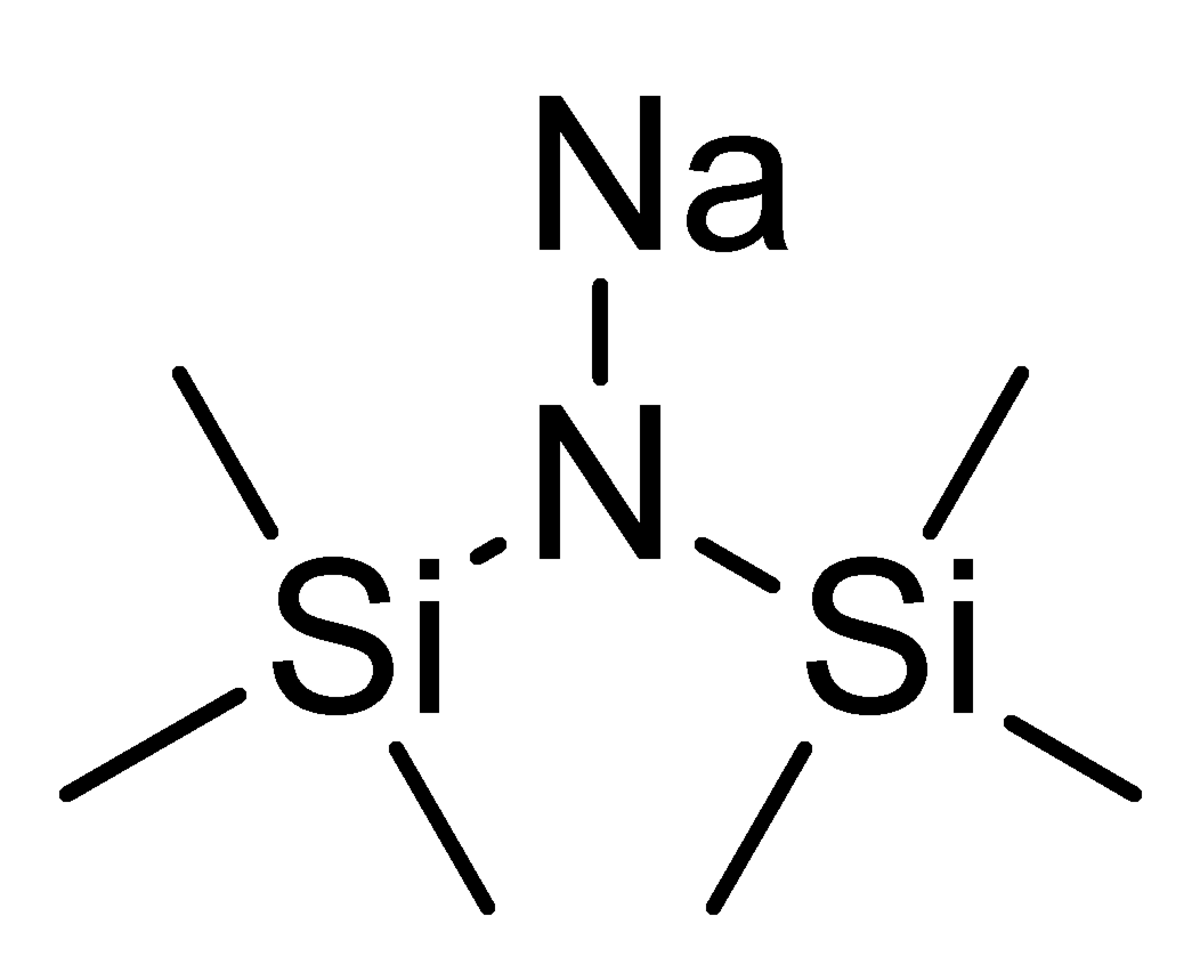
Le bis(triméthylsilyl)amidure de sodium est le composé chimique avec la formule semi-développée ((CH3)3Si)2NNa. Ce produit habituellement appelé NaHMDS (sodium hexamethyldisilazide) est une base forte utilisée pour des réactions de déprotonation ou des réactions catalysée par une base. Les avantages de ce composé sont qu'il est solide (commercialement disponible) et soluble dans un large choix de solvants aprotiques grâce aux groupes triméthylsilyl.
Le NaHMDS est rapidement détruit par l'eau pour former de l'hydroxyde de sodium et la bis(triméthylsilyl)amine.
Structure
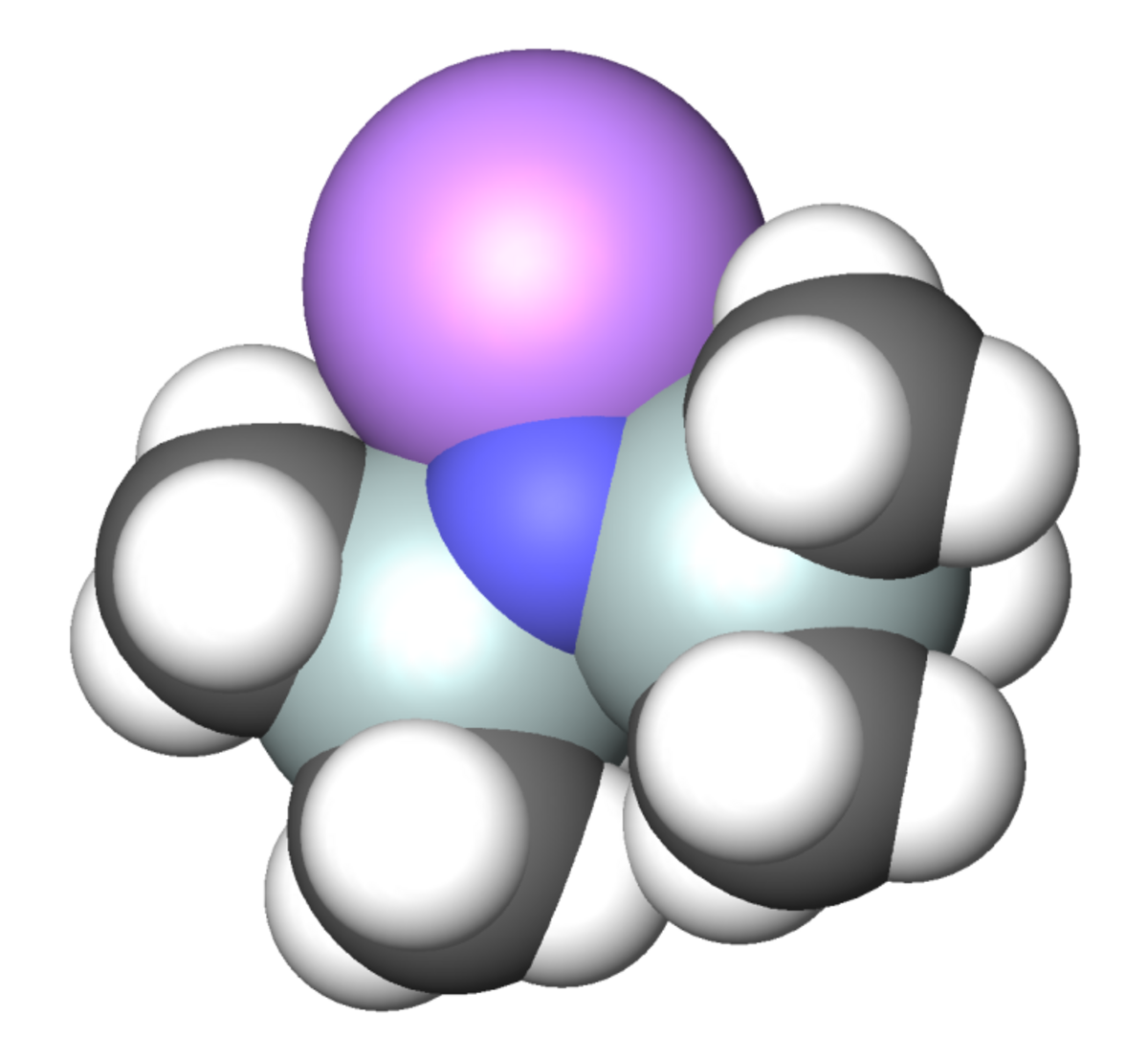
Il est commun de se figurer les composés organométalliques polaires comme des espèces ioniques alors qu'en fait la structure représentée à gauche est une meilleure représentation, la liaison N-Na est réellement covalente et polarisée.
Application en synthèse
Le NaHMDS est largement utilisé comme une base pour les liaisons C-H acides. Les réactions sont typiquement:
- déprotonation des cétones et des esters pour générer les dérivés énolates.
- génération d'halocarbènes comme CHBr ou CHI par déshydrohalogénation de CH2X2 (X = Br, I). Ces carbènes
s'additionnent sur les alcènes pour donner des cyclopropanes.
- génération des réactifs de Wittig, les ylures de phosphore par la déprotonation de phosphoniums.
- déprotonation des cyanohydrines.
Le NaHMDS est aussi utilisé pour déprotoner des liaisons N-H.
Le NaHMDS réagit avec les halogénures d'alkyle pour donner les dérivés amine :
- (CH3)3Si)2NNa + RBr → (CH3)3Si)2NR + NaBr
- (CH3)3Si)2NR + H2O → (CH3)3Si)2O + RNH2
Cette méthode a été étendue aux aminométhylations via le réactif (CH3)3Si)2NCH2OMe qui contient un groupe méthoxy labile.
- NaHMDS déprotone aussi les précurseurs qui donnent des carbènes stables(en).



















































