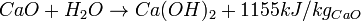Hydroxyde de sodium - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Hydroxyde de sodium | |||||
|---|---|---|---|---|---|
| |||||
| Général | |||||
| Nom IUPAC | |||||
| No CAS | (anhydre) (·H2O) | ||||
| No EINECS | (anhydre) (·H2O) | ||||
| PubChem | |||||
| No E | E524 | ||||
| SMILES | |||||
| InChI | |||||
| Apparence | solide de formes variables, blanc, deliquescent, inodore. | ||||
| Propriétés chimiques | |||||
| Formule brute | NaOH | ||||
| Masse molaire | 39,9971 ± 0,0004 g·mol-1 | ||||
| pKa | Base forte | ||||
| Propriétés physiques | |||||
| T° fusion | 318 °C | ||||
| T° ébullition | 1 390 °C | ||||
| Solubilité | dans l'eau à 20 °C : 1 090 g·l-1 | ||||
| Masse volumique | 2,1 g·cm-3 | ||||
| Pression de vapeur saturante | 0,13 kPa à 739 °C 2,67 kPa à 953 °C 13,3 kPa à 1 111 °C 53,3 kPa à 1 286 °C | ||||
| Thermochimie | |||||
| ΔH° | 175 kJ·mol-1 (1 atm, 1 388 °C) | ||||
| Précautions | |||||
| | |||||
| |||||
| Phrases R : 35, | |||||
| Phrases S : 1/2, 26, 37/39, 45, | |||||
| | |||||
| |||||
| | |||||
|
0 3 1 | |||||
| | |||||
| |||||
| | |||||

Danger | |||||
| Peau | Irritant | ||||
| Yeux | Irritant | ||||
| Composés apparentés | |||||
| Cations apparentés | Hydroxyde de potassium | ||||
| | |||||
L'hydroxyde de sodium est un solide ionique de formule statistique NaOH. La solution issue de la dissolution de ce cristal est appelée soude, voire soude caustique. La solution aqueuse d'hydroxyde de sodium peut être vendue sous le nom de « lessive de soude ». Ce produit est assez courant dans le commerce, présenté comme déboucheur de canalisations.
« Soude caustique » ne veut pas dire concentrée : c'est pour préciser clairement que ce n'est pas du carbonate de soude (Na2CO3), jadis appelé soude également.
L'hydroxyde de sodium se présente généralement sous la forme de pastilles ou de billes blanches, corrosives et hygroscopiques.
L'hydroxyde de sodium est très soluble dans l'eau et soluble dans l'éthanol. Sa Dose journalière admissible est non spécifiée depuis 1965.
La soude est une solution chimique transparente et corrosive.
L'ion hydroxyde est une base forte.
Techniques de fabrication
Historique
Dans l'Antiquité, on utilisait la soude végétale. La soude, mot qui désignait alors le carbonate de sodium, provenait des cendres obtenues par la combustion de plantes halophytes comme la salicorne ou les Soudes. La soude caustique est ensuite obtenue par caustification (voir ci-dessous). En 1791, le chimiste Nicolas Leblanc invente un procédé permettant d'obtenir du carbonate de sodium à partir d'eau de mer, procédé qui sera supplanté par le procédé Solvay en 1861 (de Ernest Solvay). Ces procédés permettent de réduire les coûts de revient de la soude. À la fin du XIXe siècle l'avènement de l'électricité permet la production directe de soude par électrolyse d'une solution de chlorure de sodium. Aujourd'hui 99 % de la soude produite est d'origine électrochimique.
Électrolyse de saumure (eau saturée en sel)
La soude est obtenue par électrolyse du chlorure de sodium NaCl.
La soude s'obtient pour le moment majoritairement par une électrolyse à mercure (anode : titane ; cathode : mercure). Cette opération produit en même temps du chlore, de la soude et de l'hydrogène. Mais le mercure est un métal lourd nocif par bioaccumulation et à très faible dose, plus encore lorsqu'il est transformé en mono- ou di-méthylmercure par les bactéries. Il est volatile et non dégradable, et passe facilement la barrière des poumons, ce qui en fait un des polluants majeurs de l'Environnement, en augmentation dans toutes les mers. C'est la raison pour laquelle ce procédé disparaitra d'ici 2020 et est en cours de remplacement par des électrolyses à membranes.
Il existe un autre procédé : électrolyse à diaphragme, qui comportait de l'amiante, substituée en France par un matériau composite depuis la fin des années 1990.
À partir de carbonate de sodium
Cette technique était celle utilisée autrefois. Elle est encore utilisée en Amérique du Nord où se trouvent des gisements naturels de carbonate de sodium. C'est un ajout de chaux (matière) au carbonate de sodium. On parle de caustification ou de caustication. La réaction s'écrit :
Na2CO3 + Ca(OH)2 → CaCO3 + 2NaOH
Fabrication de la chaux :
Par calcination du calcaire (CaCO3) aux environ de 900 °C on obtient de la chaux vive (oxyde de calcium : CaO) et un fort dégagement de dioxyde de carbone (CO2):
La réaction s'accompagne d'une perte de masse d'environ 45 %, correspondant à la perte en dioxyde de carbone selon la formulation chimique suivante :
CaCO3 → CaO + CO2
La transformation de chaux vive en chaux éteinte, s'effectue par ajout d'eau (H2O). Cette opération d'extinction produit l'hydroxyde de calcium Ca(OH)2 avec un fort dégagement de chaleur :