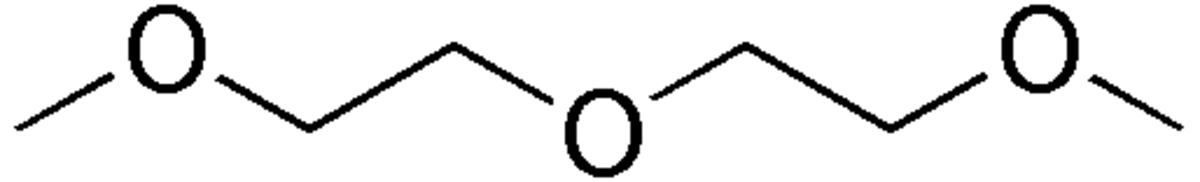
Diglyme - Définition
La liste des auteurs de cet article est disponible ici.
| Diglyme | |||
|---|---|---|---|
|
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | Bis(méthoxyéthyl)éther oxyde de bis(2-méthoxyéthyle) | ||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore | ||
| Propriétés chimiques | |||
| Formule brute | C6H14O3 | ||
| Masse molaire | 134,1736 ± 0,0067 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | -64 °C | ||
| T° ébullition | 162,05 °C | ||
| Solubilité | miscible en toute proportion dans l'eau et l'éther | ||
| T° d’auto-inflammation | 190 °C | ||
| Point d’éclair | 51 °C | ||
| Limites d’explosivité dans l’air | 1,3–17,4 %vol | ||
| Pression de vapeur saturante | 2 mbar à 20 °C 14 mbar à 50 °C | ||
| Thermochimie | |||
| S0 | 352,7 J·mol-1·K-1 | ||
| ΔH0 | -521,3 J·mol-1·K-1 | ||
| ΔH0 | -556,4 kJ·mol-1 | ||
| ΔH° | 17,795 kJ·mol-1 à -64,05 °C | ||
| ΔH° | 44,7 kJ·mol-1 à 25 °C | ||
| Cp | 277,76 J·mol-1K·-1 à 25 °C | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 10, 19, 60, 61, | |||
| Phrases S : 45, 53, | |||
| | |||
| |||
| Écotoxicologie | |||
| DL | 6 g·kg (souris, oral) 5,4 g·kg (rat, oral) | ||
| LogP | -0,36 | ||
| | |||
Le diglyme, ou di(2-méthoxyéthyl)éther, est un éther de formule brute C6H14O3. C'est le diméthyl éther de l'éthylène glycol, et son nom provient de la contraction de "diglycol méthyl éther". C'est un liquide clair et incolore avec une légère odeur d'éther. Il est miscible avec l'eau, les alcools, les éthers et même les hydrocarbures liquides. Son point d'ébullition est particulièrement élevé.
Le diglyme est principalement utilisé comme solvant pour des réactions organiques. Il a la capacité de chélater de petits cations ce qui renforce la réactivité des anions. Ainsi, des réactions qui impliquent de réactifs organo-métalliques, comme les organo-magnésiens (réaction de Grignard) ou les hydrures métalliques dans des réductions, peuvent avoir leur vitesse significativement augmentée.
Le diglyme peut être aussi utilisé comme solvant pour les réactions d'hydroboration avec le diborane. Sa stabilité, même à des valeurs de pH élevées, en font un excellent solvant pour les réactions avec des bases fortes et avec les réactions qui requièrent de hautes températures.