Diborane - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Diborane | |||
|---|---|---|---|
| |||
| Général | |||
| No CAS | |||
| No EINECS | |||
| SMILES | |||
| InChI | |||
| Apparence | gaz comprime, incolore, d'odeur caractéristique. | ||
| Propriétés chimiques | |||
| Formule brute | B2H6 | ||
| Masse molaire | 27,67 ± 0,014 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | -165 °C | ||
| T° ébullition | -92 °C | ||
| Solubilité | dans l'eau : hydrolysé en dihydrogène et en acide borique | ||
| Masse volumique | 1,18 kg/m3 à 15 °C | ||
| T° d’auto-inflammation | 40 à 50 °C | ||
| Point d’éclair | 38 °C | ||
| Limites d’explosivité dans l’air | 0,8–88 %vol | ||
| Point critique | 40,5 bar, 16,65 °C | ||
| Thermochimie | |||
| ΔH° | 14,28 kJ·mol-1 (1 atm, -92,49 °C) | ||
| Précautions | |||
| | |||
| |||
| | |||
|
4 4 3 | |||
| Écotoxicologie | |||
| Seuil de l’odorat | bas : 1,8 ppm haut : 3,5 ppm | ||
| | |||
Le diborane est un composé chimique de bore et d'hydrogène de formule B2H6. C'est la combinaison de deux molécules de borane BH3 liées par deux de leurs atomes d'hydrogène. A température ambiante, c'est un gaz incolore avec une odeur douçâtre qui s'enflamme facilement en présence d'humidité. Il forme avec l'air des mélanges hautement explosifs.
C'est un composé clef du bore, aux applications variées. Il est endothermique, présentant une enthalpie libre de formation positive (36 kJ.mol-1). Il tend donc à se décomposer en libérant du dihydrogène H2, mais avec une cinétique assez lente.
Propriétés et structure
Le diborane est un gaz incolore plus léger que l’air qui se condense à -92,5 °C sous 101,3 kPa avec une masse volumique de 421 g.m-3 et une chaleur latente de 515,39 kJ.mol-1. Il gèle à -165 °C. À 15 °C, sa tension de vapeur est de 3,94 MPa et son rapport de volumes gazeux/liquide est égal à 362. Gazeux, il est très inflammable et peut provoquer spontanément de violentes explosions dans l’air. Son point critique se trouve à 16,6 °C et 4,053 MPa.
Le diborane se décompose lentement dès la température ambiante en dihydrogène et en hydrures de bore supérieurs. Cette décomposition s’accélère avec l’accroissement de la température. Il est notamment très sensible à l’humidité et s’hydrolyse instantanément en dihydrogène et acide borique HBO en une réaction très exothermique :
- B2H6 + 6 H2O → 2 H3BO3 + 6 H2
Au contact du lithium et de l’aluminium, le diborane donne des hydrures qui peuvent s’enflammer spontanément. Il n’exerce pas d’action corrosive sur les métaux usuels mais attaque la plupart des caoutchoucs et des matières plastiques, excepté par exemple le polytétrafluoroéthylène [CF2-CF2]n et le polychlorotrifluoroéthylène [CClF-CF2]n.
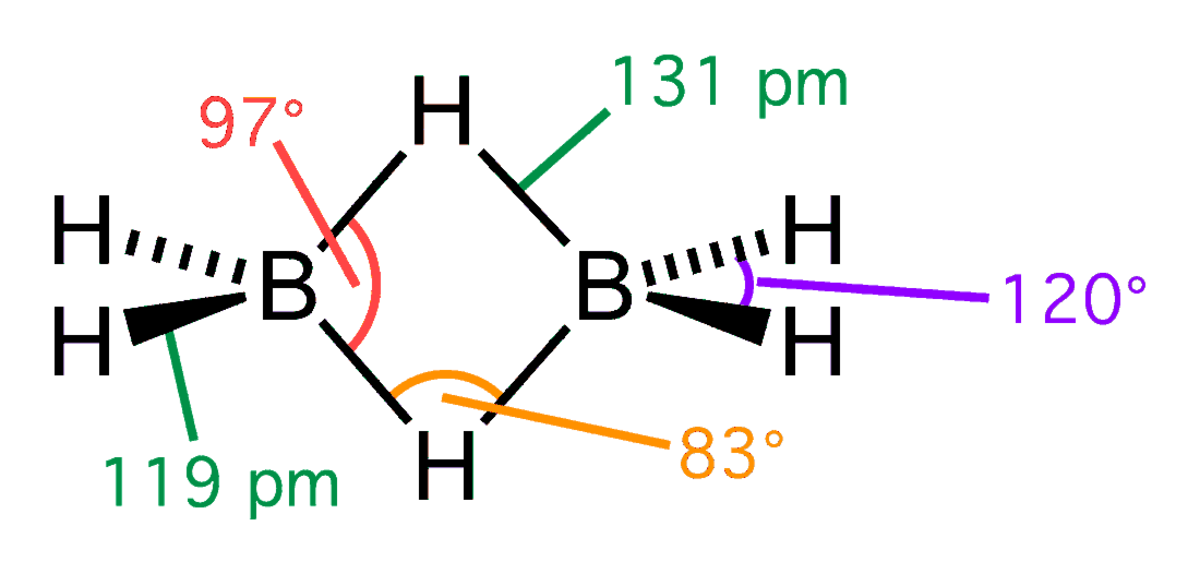
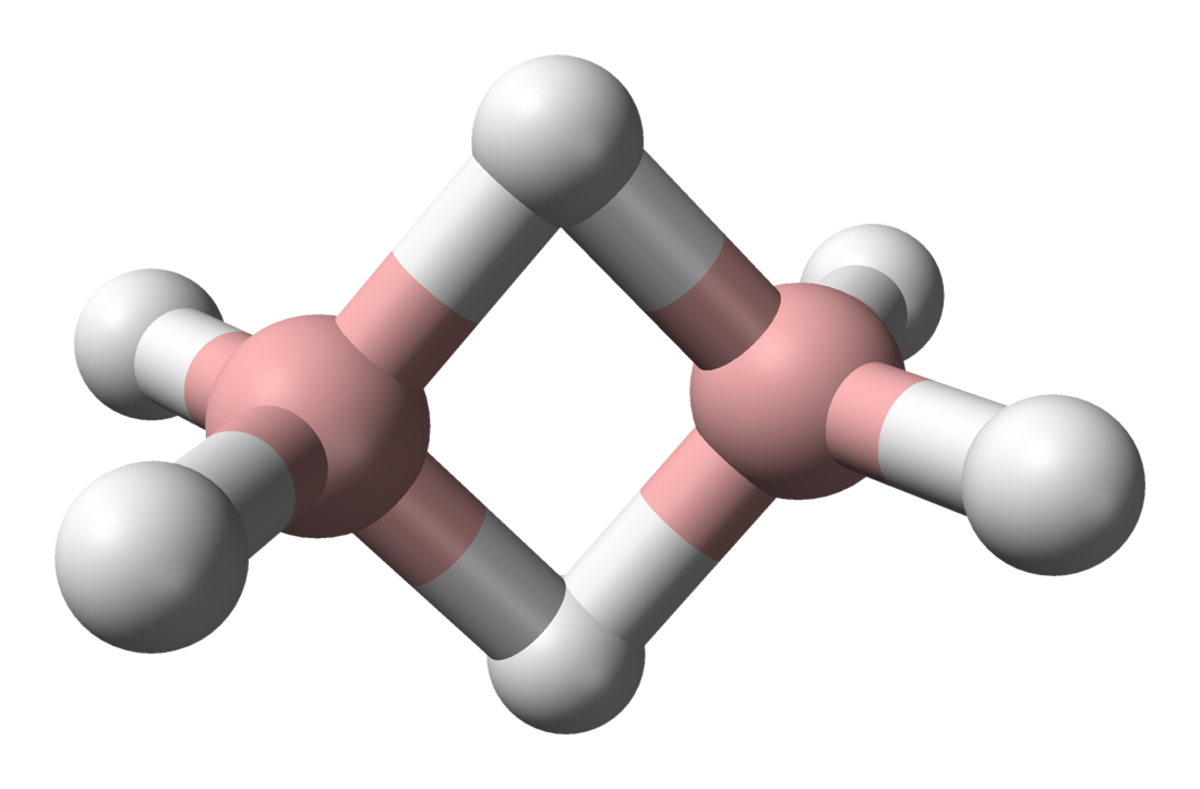
Le diborane a une structure D2h avec deux atomes d'hydrogène liants et quatre terminaux. Les liaisons entre les atomes de bore et les hydrogènes terminaux sont conventionnelles (une paire d'électrons impliquée dans chaque liaison B-H, formant une liaison covalente), mais celles entre les atomes de bore et les hydrogènes liants sont d'une nature différente (une paire d'électrons impliquée dans chaque pont B-H-B, formant une liaison à trois centres et deux électrons). La longueur de ces liaisons est par conséquent différente : 119 pm pour les B-H terminaux, mais 133 pm pour les liaisons B-H des ponts B-H-B, ce qui signifie que la force de ces liaisons est également différente (plus faible dans le pont B-H-B que dans la liaison B-H terminale).
Le gallium forme un composé de structure semblable : le digallane Ga2H6.