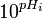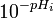Graphe de Gran - Définition
La liste des auteurs de cet article est disponible ici.
Littérature citée
- Buffle, J., Parthasarathy, N. et Monnier, D. (1972): Errors in the Gran addition method. Part I. Theoretical Calculation of Statistical Errors; Anal. Chim. Acta 59, 427-438; Buffle, J. (1972): Anal. Chim. Acta 59, 439.
- Butler, J. N. (1991): Carbon Dioxide Equilibria and Their Applications; CRC Press: Boca Raton, FL.
- Butler, J. N. (1998): Ionic Equilibrium: Solubility and pH Calculations; Wiley-Interscience. Chap. 3.
- Gans, P. et O'Sullivan, B. (2000): GLEE, a new computer program for glass electrode calibration; Talanta, 51, 33–37.
- Gran, G. (1950): Determination of the equivalence point in potentiometric titrages, Acta Chem. Scand., 4, 559-577.
- Gran, G. (1952): Determination of the equivalence point in potentiometric titrages-- Part II, Analyst, 77, 661-671.
- Gran, G., Johansson, A. et Johansson, S. (1981): Automatic titrage by Stepwise Addition of Equal Volumes of Titrant Part VII. Potentiometric Precipitation titrages, Analyst, 106, 1109-1118.
- Harris, D. C.: Quantitative Chemical Analysis, 5th Ed.; W.H. Freeman & Co., New. York, NY, 1998.
- Martell, A. E. et Motekaitis, R. J.: The determination and use of stability constants, Wiley-VCH, 1992.
- McBryde, W. A. E. (1969): Analyst, 94, 337.
- Rossotti, F. J. C. et Rossotti, H. (1965): J. Chem. Ed., 42, 375
- Skoog, D. A., West, D. M., Holler, F. J. et Crouch, S. R. (2003): Fundamentals of Analytical Chemistry: An Introduction, 8th Ed., Brooks and Cole, Chap. 37.
- Stumm, W. et Morgan, J. J. (1981): Aquatic chemistry, 2nd Ed.; John Wiley & Sons, New York.
Comportement non-idéal
Dans toute titrage sans espèces tampons, les graphes avant et après l'équivalence devraient idéalement croiser l'abscisse au même point, mais un comportement non-idéal peut être occasionné par des erreurs de mesures (e.g. avec un électrode mal calibré, un temps équilibration insuffisant avant d'enregistrer le potentiel, une dérive de la force ionique), des erreurs d'échantillonnage (e.g. une densité de données faible dans les régions linéaires) ou par un modèle chimique incomplet (e.g. avec la présence d'impuretés titrables telle que le dans la base, ou une précipitation incomplète lors d'un titrage potentiométrique à cause de solutions trop diluées, pour lequel cas Gran et al. (1981) propose des approches alternatives). Buffle et al. (1972) discutent de plusieurs sources de telles erreurs.
Parce que les fonctions en