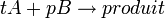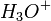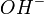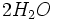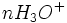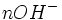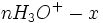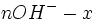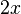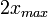Titrage - Définition
La liste des auteurs de cet article est disponible ici.
Introduction

La titrimétrie ou titrage est une technique de dosage utilisée en chimie analytique afin de déterminer la concentration d'une espèce chimique en solution (ou titre d'une solution).
La méthode de titrage la plus utilisée est la volumétrie ou titrage volumétrique. Elle consiste à utiliser une solution de concentration connue (appelée titrant) afin de neutraliser une espèce contenue dans la solution inconnue (appelée analyte ou espèce titrée).
Les titrages volumétriques les plus répandus sont les titrages acide-base : L'opérateur fait couler goutte à goutte un acide dans un volume déterminé de base. Ainsi les réactifs réagissent mol à mol. Le titrage base-acide est aussi possible.
Le point de neutralisation est connu grâce à un indicateur coloré ajouté dans la solution inconnue (Cet indicateur change de couleur au moment de la neutralisation) ou grâce à une variation du potentiel ou du pH (mesuré au moyen d'une électrode trempant dans la solution inconnue).
Matériel nécessaire
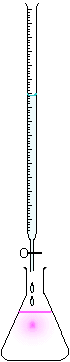
On utilise en général une burette graduée quand le titrage est manuel ou un titrimètre automatique quand on souhaite améliorer la répétabilité et la traçabilité. Le volume de l'échantillon est prélevé au moyen d'une pipette de volume déterminé et est placé dans un erlenmeyer. La burette contient toujours la solution de réactif titrante dont on connaît la concentration. La burette donne le volume versé de solution titrante et donc nous donnera le point à l'équivalence. La solution à doser sera toujours dans un becher ou autre récipient propre, elle sera en volume exactement connu.
Calculs
Le but d'un titrage est de trouver la concentration en un élément donné. Il existe pour cela deux moyens possibles : par le calcul et par un tableau d'avancement. Dans les deux cas il faut connaître l'équation bilan de la réaction.
Méthode mathématique
A l'équivalence, on a
- Donc
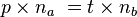
- D'où
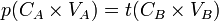
- donc
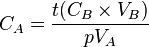
Avec :
-
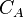
-
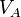
-
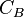
-
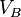
-
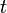
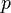
Cette formule est générale quels que soient les coefficients (ou nombres) stoechiométriques.
En raisonnant avec les concentrations alors les coefficients stoechiométriques interviennent.
Tableau d'avancement
Le bilan de la réaction s'écrit comme ceci :
|
|
|
|
| |
|---|---|---|---|---|
| Etat initial |
|
|
| |
| Etat intermédiaire |
|
|
| |
| Etat Final |
|
|
|
Au début du titrage, (quand vous n'avez encore rien versé), vous n'avez que des réactifs et aucun produit de réaction. Au fur et à mesure que votre réaction se déroule, une quantité x de réactif disparaît, alors qu'en même temps une quantité x de produit apparaît. C'est l'application de la loi de lavoisier. A la fin du titrage, c'est-à-dire quand un de vos réactifs a totalement disparu (celui se trouvant dans votre erlen) vous avez atteint l'avancement maximal, votre réaction ne peut pas aller plus loin.
A ce moment-là
-
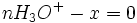
-
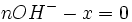
- donc
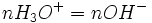
-
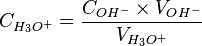
Ce tableau permet de comprendre ce qui ce passe pendant la réaction et de ne pas vous tromper avec les coefficients. En effet vous avez juste à les reporter devant le X . Normalement quand vous avez de l'eau dans votre réaction vous devez écrire "en excès" (vous avez toujours plus d'eau qu'il n'en faut pour que la réaction se déroule)