Iodoforme - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Iodoforme | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| Apparence | cristaux jaunâtres | ||
| Propriétés chimiques | |||
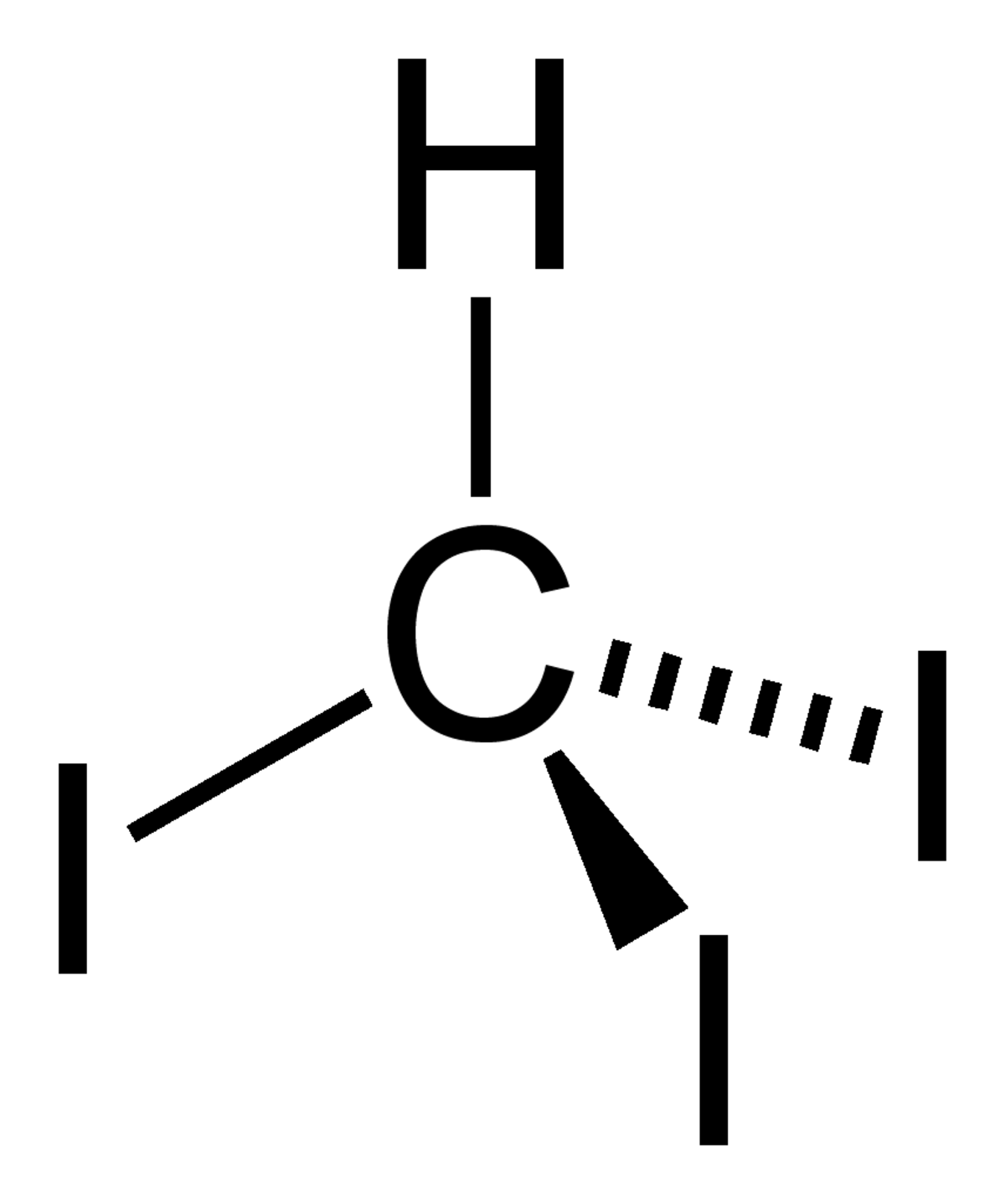
| Formule brute | CHI3 | ||
| Masse molaire | 393,7321 ± 0,001 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | 123 °C | ||
| T° ébullition | 217 °C (explose) | ||
| Solubilité | 0,1 g·l-1 (eau,20 °C) | ||
| Masse volumique | 4,008 g·cm-3 | ||
| Point d’éclair | 204 °C | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 9,25 ± 0,02 eV (gaz) | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 20/21/22, 36/37/38, | |||
| Phrases S : 22, 26, 36/37/39, | |||
| | |||

| |||
| Écotoxicologie | |||
| Seuil de l’odorat | bas : 1,9×10-5 ppm haut : 1,1 ppm | ||
| | |||
L’iodoforme ou triiodométhane était autrefois l’antiseptique par excellence et c’est cette odeur qui caractérisait les cabinets médicaux.
Les molécules qui renferment le groupe CH3-CO- ou CH3-CHOH- donnent, lorsqu’elles sont traitées par une solution alcaline de potassium iodé, un précipité jaune d’iodoforme (CHI3), dont l’odeur spéciale (un peu safranée) est caractéristique et tenace.
Synthèse
Le premier rapport de préparation de l'iodoforme date de 1822 par Georges Serullas, et sa formule moléculaire a été identifiée par Jean-Baptiste Dumas en 1834. Elle a été synthétisée par réaction haloforme, réaction du diiode en milieu basique sur un des quatre types de composés suivants:
- une méthylcétone: CH3COR, où R est une chaîne organique,
- l'acétaldéhyde (CH3CHO),
- l'éthanol (CH3CH2OH),
- et certains alcools secondaires, oxydables en méthylcétone (CH3CHROH, où R est un groupement alkyl ou aryl).
Cette réaction, appelée « test iodoforme », est utilisé pour la détection de méthylcétone par apparition d'un précipité jaune.