Réaction haloforme - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
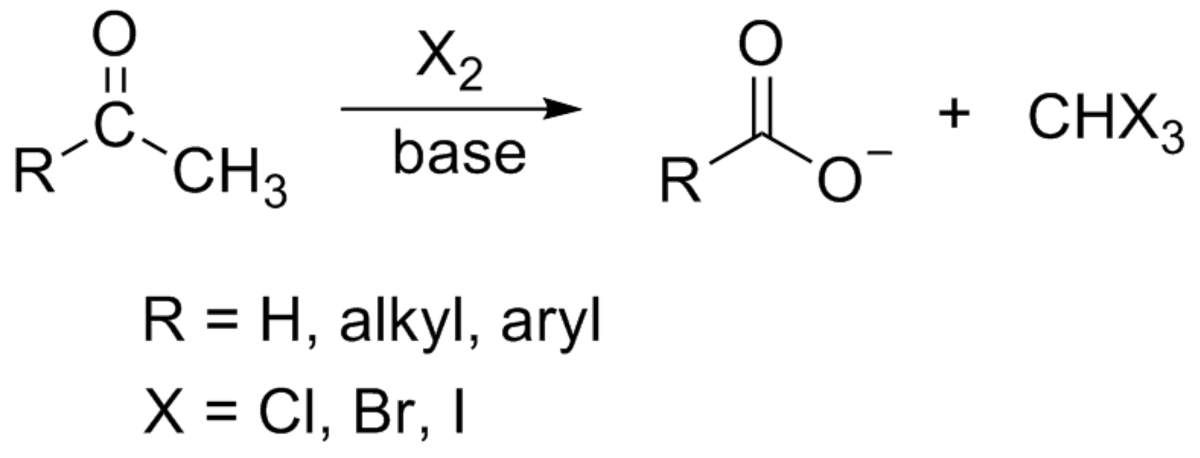
La réaction haloforme est la réaction chimique consistant à synthétiser un haloforme, c'est-à-dire un trihalogénométhane avec trois atomes halogènes identiques (chloroforme (CHCl3), iodoforme (CHI3), bromoforme (CHBr3) — le fluoroforme (CHF3) ne pouvant être obtenu par cette réaction), par l'halogénation d'une cétone méthylée (une molécule présentant la chaine R-C(=O)-CH3) en milieu basique.
Historique
La réaction haloforme est l'une des plus vieilles réaction organique décrite en tant que tel.
En 1822, Georges Serullas fit réagir de l'éthanol avec du diiode et de l'hydroxyde de sodium dans l'eau, formant du formate de sodium et de l'iodoforme, appelé alors hydroïodide de carbone. En 1831, Justus von Liebig rapporta la réaction du chloral avec l'hydroxyde de calcium formant chloroforme et formate de calcium. Cette réaction fur redécouverte par Adolf Lieben en 1870. C'est pourquoi le « test iodoforme » est parfois appelé la réaction haloforme de Lieben. Un récapitulatif historique sur la réaction haloforme fut publiée en 1934.
Mécanisme général
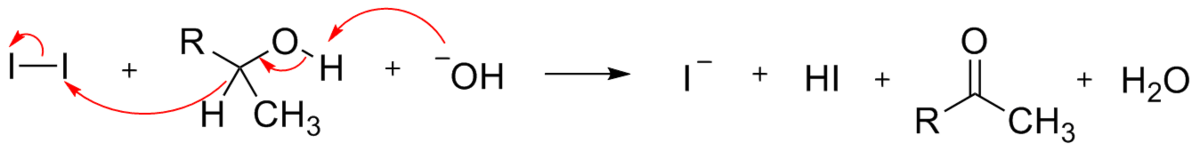
La première étape de ce mécanisme est la transformation du dihalogène en ion hypohalite (ion XO-), par réaction avec un ion hydroxyde (soude, potasse, etc.):
- X2 + OH−→ XO−+ X− + H+ (X = Cl, Br, I)
À ce stade intervient une première limite au mécanisme. Si la réaction se produit convenablement avec le dichlore (Cl2), le dibrome (Br2) ou le diiode (I2), le difluor (F2) ne réagit lui pas bien. En effet, l'ion hypofluorite (FO-) est beaucoup trop instable pour être synthétisé de cette façon, et pouvoir ensuite être utilisé pour la suite de la synthèse, ce qui interdit la synthèse du fluoroforme par cette réaction. Il est cependant possible de le synthétiser à partir de l'intermédiaire suivant, R-(C=O)-CF3, suivant les réactions à partir de la troisième étape.
Si le second réactif utilisé n'est pas une cétone méthylée, mais un alcool secondaire oxydable en cétone méthylée, celui-ci est oxydé par l'ion hydroxyde en présence de dihalogène:
La seconde étape est la réaction de la cétone méthylée avec l'ion hypohalite.
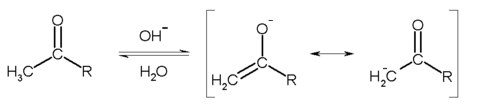
- Cette étape commence par l'arrachage d'un hydrogène du groupe méthyle par la base, stabilisé par l'équilibre de tautomérie entre la forme cétone et la forme énolate :
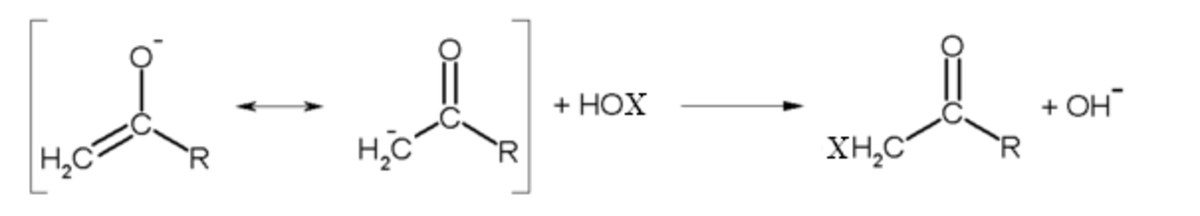
- L'énolate subit ensuite une attaque électrophile de la part de l'ion hypohalite:
- La cétone monosubsituée subit alors encore deux fois le même mécanisme, jusqu'à l'obtention d'une cétone méthylée complètement substituée:
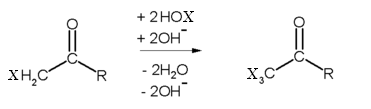
La troisième étape du mécanisme consiste au départ de l'ion CX3-, par un mécanisme de substitution nucléophile acylique par l'ion hydroxyde, formant un carbanion trisubstitué stabilisé par effet inductif.
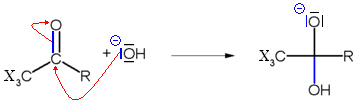
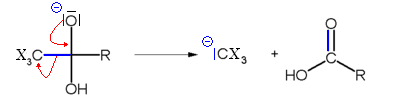
La dernière étape consiste en une réaction acide base entre le carbanion trisubstitué et l'acide carboxylique, formant l'haloforme et un ion carboxylate.
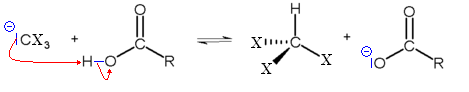
Réactifs
Les seuls réactifs susceptibles de réagir par la réaction haloforme sont les cétones méthylées et les alcools secondaires qui peuvent être oxydés en cétones méthylées, comme par exemple l'isopropanol. L'halogène utilisé peut être dichlore (Cl2), le dibrome (Br2) ou le diiode (I2), mais pas le difluor (F2) (voir mécanisme ci-dessous).