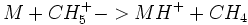Ionisation - Définition
L'ionisation est l'action qui consiste à enlever ou ajouter des charges à un atome ou une molécule. L'atome - ou la molécule - en perdant ou en gagnant des charges n'est plus neutre électriquement. Il est alors appelé ion.
Les applications sont nombreuses :
- décontamination alimentaire
- modifications des plastiques
- stérilisation des matériels médicaux
- étude des matériaux
- etc.
Énergie de première ionisation
C'est l'énergie nécessaire pour extraire le premier électron (c’est-à-dire l'électron dont l'énergie de liaison est la plus faible) de la structure atomique.
Formule générique décrivant l'ionisation à un électron : X − > X + + e −
Impact électronique
Ce type d'ionisation est courament utilisé en spectrométrie de masse. Un électron émis par un filament rencontre l'atome ou la molécule et lui arrache lors du choc un de ses électrons (spectrométrie de masse).
Exemple avec le méthane : CH4 + e − − > CH4 + + + 2e −
Photo-ionisation
L'ionisation peut être réalisée par des rayonnements de longueur d'onde suffisante pour éjecter cet électron périphérique. Lorsque le rayonnement ionisant est constitué de photons, on parle de photoionisation. C'est par exemple ce qui se passe dans les nébuleuses planétaires.
Ionisation thermique
Si on apporte suffisamment d'énergie thermique à un gaz, son énergie moyenne peut devenir égale ou supérieure à son énergie d'ionisation. Les constituants de ce gaz peuvent donc s'ioniser sous les chocs entre atome/molécule.
L'énergie moyenne d'un gaz parfait est égale à
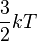
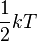
k correspond à la constante de Boltzmann.
T correspond à la température.
Ionisation chimique
C'est une réaction entre une molécule et un ion réactant. Le résultat donnera lieu a un transfert de proton ou a la création d'adduit.
Exemple avec une molécule M :