Laurylsulfate de sodium - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Laurylsulfate de sodium | |
|---|---|
| |
| Général | |
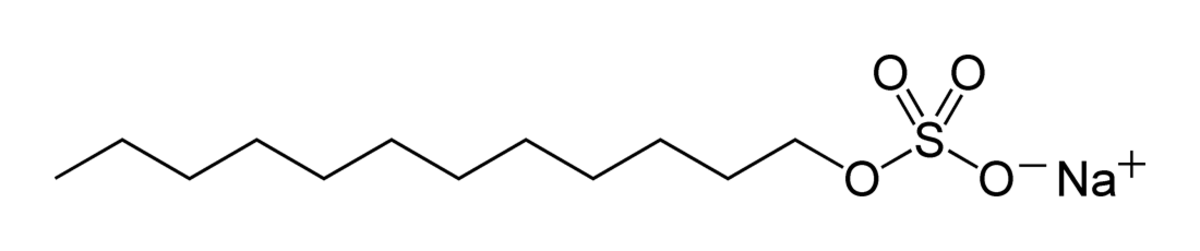
| Synonymes | Dodécylsulfate de sodium |
| No CAS | |
| No EINECS | |
| No E | E487 |
| SMILES | |
| Apparence | solide de formes variables, blanc, d'odeur caractéristique. |
| Propriétés chimiques | |
| Formule brute | C12H25NaO4S |
| Masse molaire | 288,379 ± 0,018 g·mol-1 |
| Propriétés physiques | |
| T° fusion | 204 à 207 °C |
| Solubilité | dans l'eau : 100 g·l-1 |
| Masse volumique | 1,01 g·cm-3 |
| Précautions | |
| | |

| |
| | |
Le laurylsulfate de sodium ou dodécylsulfate de sodium (SDS) est un détergent et surfactant ionique fort, couramment utilisé en biochimie et biologie moléculaire.
C'est un composé à ne pas confondre avec le laureth sulfate de sodium.
Généralités
Le dodécylsulfate de sodium (en anglais, Sodium Dodecyl Sulfate ou SDS ou/ NaDS), de formule C12H25NaO4S, aussi connu sous le nom de laurylsulfate de sodium (en anglais, sodium lauryl sulfate ou SLS), est un surfactant ionique qui est utilisé dans les produits ménagers tels que les dentifrices, shampooings, mousses à raser ou encore bains moussants pour ses effets épaississants et sa capacité à créer une mousse, il est également repris comme additif alimentaire par le codex alimentarius (E487).
La molécule est composée d’une chaîne de 12 atomes de carbone, rattachée à un groupement sulfate conférant à la molécule les propriétés amphiphiles requises pour un détergent. Le SDS est préparé par sulfonation du dodécanol (alcool de lauryl, C12H25OH), suivie par une neutralisation par du carbonate de sodium. Le SDS est utilisé aussi bien dans les procédés industriels que pour les produits cosmétiques destinés au grand public. Comme tous les détergents surfactants (incluant les savons), il enlève l’huile de la peau, et peut causer des irritations de la peau et des yeux. Le SDS peut être converti en laureth sulfate de sodium (également nommé Sodium Lauryl Ether Sulfate ou SLES) par éthoxylation ; ce dernier est moins irritant pour la peau, probablement parce qu’il provoque moins de dénaturation des protéines par rapport à la substance non-éthoxylée (SDS).
C’est probablement le composé surfactant anionique le plus recherché.
En laboratoire, le SDS est communément utilisé afin de préparer des protéines pour réaliser une électrophorèse en gel de polyacrylamide (SDS-PAGE). Le SDS supprime les liaisons non-covalentes de la protéine, permettant la dénaturation de la protéine, la molécule perd donc à terme sa conformation initiale. De plus, les anions du SDS se lient aux peptides à raison d’un anion du SDS tous les deux acides aminés. Cela confère à la protéine une charge globale négative qui est proportionnelle à la masse de la protéine (environ 1,4 g de SDS pour 1 g de protéine). La nouvelle charge négative est significativement plus grande que la charge initiale de cette protéine. La répulsion électrostatique qui est créée par la liaison du SDS cause un déploiement des protéines en une conformation proche d’un triangle, ainsi les différences dues à la conformation de la protéine, apparaissant habituellement au cours de la séparation du gel, sont écartées.
Plus récemment, le SDS a trouvé une application comme surfactant pour les réactions de formation d’hydrates de gaz ou d’hydrates de méthane, augmentant le taux de formation de près de 700 fois.
























































