Sulfate de sodium - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Sulfate de sodium | |
|---|---|

| |
| Général | |
| No CAS | |
| No EINECS | |
| No E | E514 |
| Apparence | solide blanc |
| Propriétés chimiques | |
| Formule brute | Na2SO4 Heptahydrate Na2SO4·7H2O Décahydrate: Na2SO4·10H2O |
| Masse molaire | 142,042 ± 0,006 g·mol-1 |
| Propriétés physiques | |
| T° fusion | 884 °C, anhydre 32,4 °C décahydrate |
| Solubilité | 47,6 g·kg-1 (eau, 0 °C) 427 g·kg-1 (eau, 100 °C) |
| Masse volumique | 2.68 (anhydre) |
| Thermochimie | |
| ΔH0 | 78.2 kJ/mol |
| Cristallographie | |
| Système cristallin | monoclinique, orthorhombique ou hexagonal |
| Précautions | |
| | |
| Produit non contrôlé | |
| Peau | Irritant |
| | |
Le sulfate de sodium est un composé chimique courant formé d'un ion sulfate et de deux ions sodium. Lorsqu'il est anhydre, il prend l'apparence d'un solide cristallin blanc de formule chimique Na2SO4. La forme déca-hydratée, Na2SO4·10H2O, est connue sous le nom de sel de Glauber ou mirabilite. Parmi un grand nombre d'usages différents, les principales utilisations du sulfate de sodium concernent la fabrication des détergents et dans le procédé de Kraft de traitement de la pâte à papier. La moitié environ de la production mondiale provient de l'extraction de la forme naturelle décahydratée, et l'autre moitié de productions secondaires dans des procédés de l'industrie chimique.
Histoire
La forme naturelle décahydratée du sulfate de sodium porte le nom de sel de Glauber, ou sal mirabilis. Elle a été baptisée d'après Johann Rudolf Glauber, qui la découvrit au XVIIe siècle. Elle se présentait sous la forme de cristaux blancs ou transparents, utilisés originellement comme laxatifs.
Extraction du sulfate de sodium
La moitié environ de la production mondiale provient de l'extraction de la forme décahydratée (sel de Glauber) du lit de lacs. En 1990, les principaux producteurs de sulfate de sodium naturel étaient le Mexique et l'Espagne (avec chacun environ 500 000 tonnes) suivis par l'URSS, les É.-U. et le Canada (avec chacun environ 350 000 tonnes).
On peut également trouver le sulfate de sodium dans une forme moins hydratée, la thenardite dans des environnements arides. Elle se transforme rapidement en mirabilite à l'air humide.
Propriétés physiques et chimiques
Le sulfate de sodium est très stable chimiquement. Il ne se décompose pas même sous l'effet de la chaleur, et il ne réagit pas aux températures courantes avec des agents oxydants ou réducteurs. A des températures élevées, il peut être réduit en sulfure de sodium. Etant dérivé d'un acide fort (acide sulfurique H2SO4) et d'une base forte (hydroxyde de sodium NaOH ou Bicarbonate de sodium), c'est un sel neutre dont la solution aqueuse est de pH 7.
Le sulfate de sodium peut réagir en solution aqueuse. Il réagit notamment avec une quantité équivalente d'acide sulfurique pour former un sel d'acide selon un équilibre chimique, comme par exemple dans la réaction suivante :
Na2SO4(aq) + H2SO4(aq) ⇔ 2 NaHSO4(aq)
En réalité, l'équilibre est beaucoup plus complexe et dépend à la fois de la concentration et de la température, tout en mettant en jeu d'autres sels d'acide.
Na2SO4 constitue typiquement un sulfate ionique. Il peut former des précipités en solution aqueuse lorsqu'il est combiné avec des sels de baryum ou de plomb qui forment des sulfates insolubles :
Na2SO4(aq) + BaCl2(aq) → 2 NaCl(aq) + BaSO4(s)
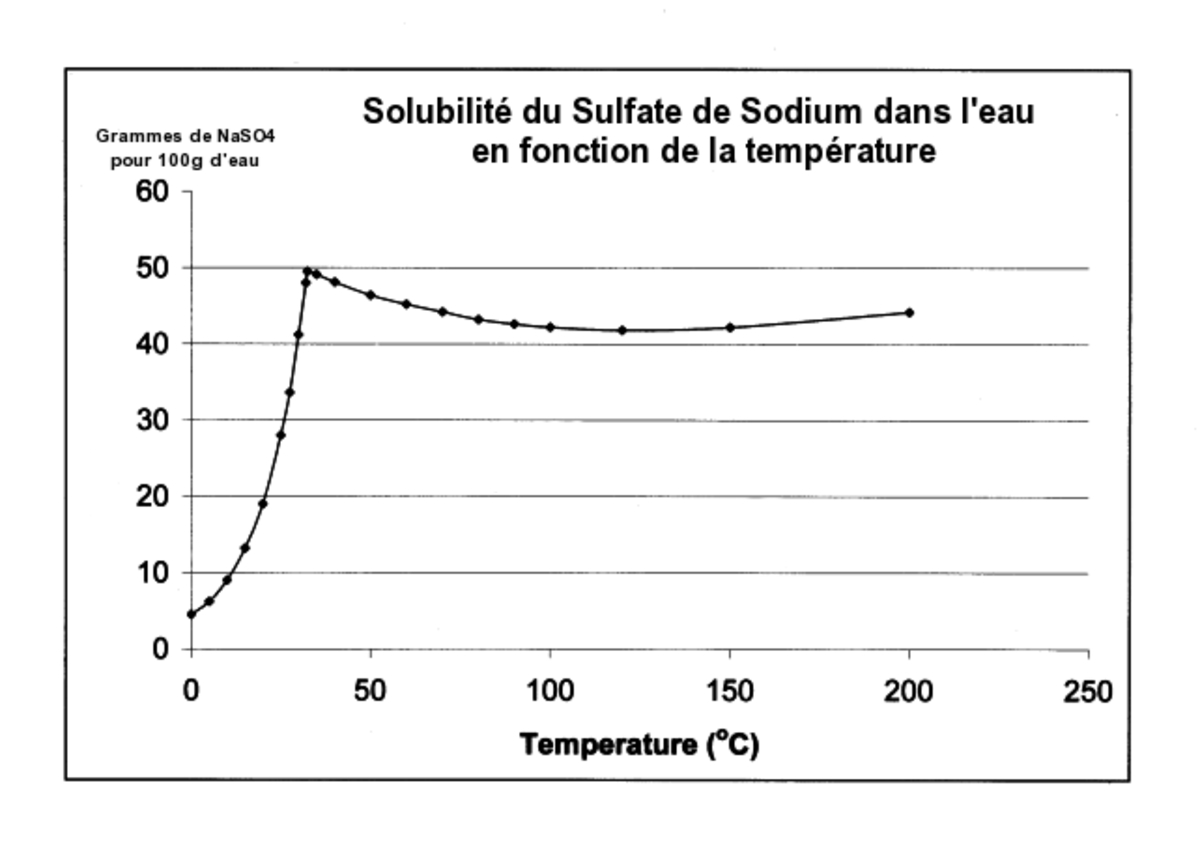
L'évolution de la solubilité du sulfate de sodium dans l'eau en fonction de la température est assez inhabituelle, comme le montre la courbe ci-après. La solubilité croît de plus d'un facteur 10 entre 0 °C et 32,4 °C, température à laquelle elle atteint un maximum de 49.7g pour 100g d'eau. A cette température, l'évolution change brusquement et la solubilité devient presque indépendante de la température. La solubilité est nettement plus faible si l'on ajoute du chlorure de sodium dans la solution. Cette évolution inhabituelle de la solubilité avec la température est à la base de l'utilisation du sulfate de sodium dans des systèmes passifs de chauffage solaire.
Cette caractéristique de la solubilité du sulfate de sodium peut être expliquée par le fait que 32,4 °C correspond à la température à laquelle la forme décahydratée (sel de Glauber ) se décompose pour former une phase liquide est une phase solide anhydre.