Mésomérie - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
En chimie, la mésomérie désigne une délocalisation d'électrons dans les molécules conjuguées, que l'on représente par une combinaison virtuelle de structures aux électrons localisés appelées mésomères ou formes de résonance. Faute de moyens graphiques plus simples pour les décrire correctement, la mésomérie est donc une représentation simplifée des systèmes moléculaires, qui sont plus précisément décrits par des approches de chimie quantique. Le terme « mésomérie » est dû à Ingold mais le terme synonyme « résonance », proposé plus tôt par Pauling, est plus courant en anglais.
Insuffisance des formules de Lewis
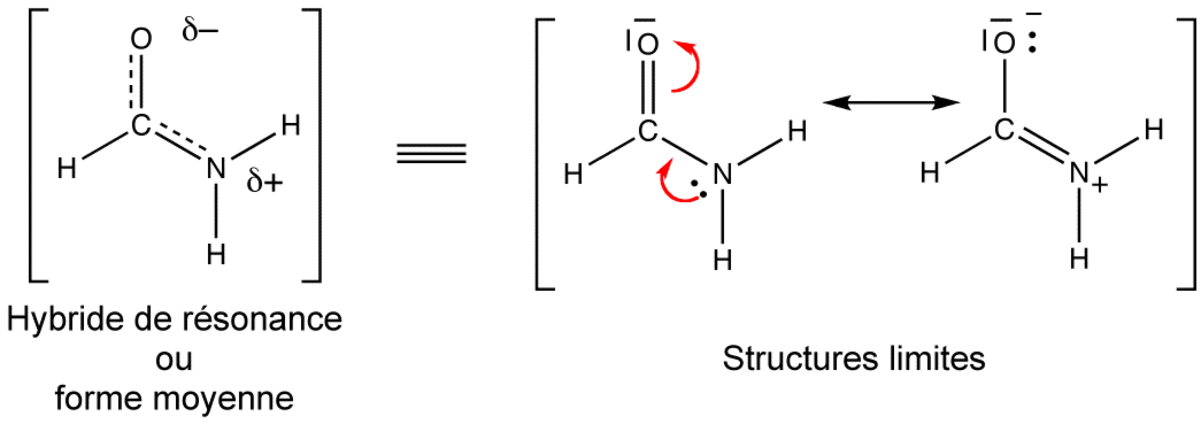
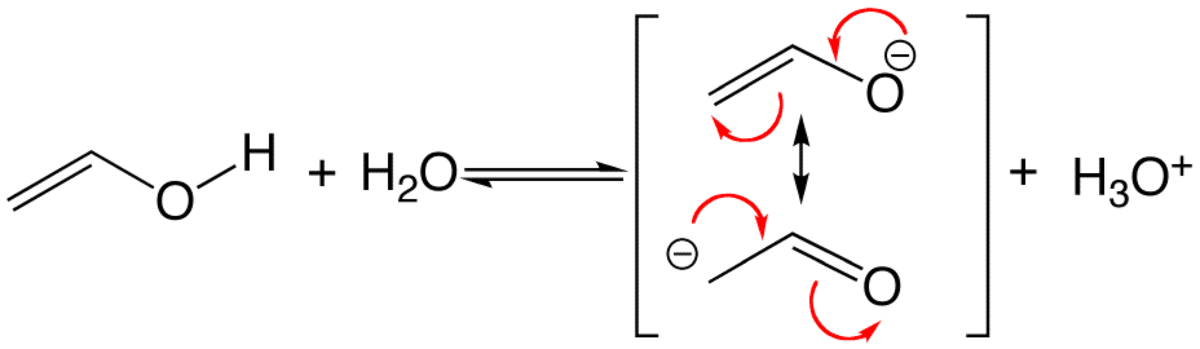
On peut parfois écrire plusieurs formules de Lewis possibles pour un même assemblage d'atomes. Dans ces cas, la molécule n'est clairement pas décrite correctement par une seule de ces formes, qui sont nommées formes limites, mais par une combinaison, un hybride de ces formes. En invoquant ainsi plusieurs formules de Lewis, on peut rendre compte de certaines propriétés physiques (charges électroniques, polarité, distances interatomiques, couleur, etc.) et chimiques (stabilité, réactivité) de certains types de molécules. La mésomérie est symbolisée par une double flèche (
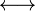
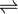
Les formules de Lewis contribuantes ayant leurs électrons localisés différemment, la mésomérie entre elles traduit à sa façon la délocalisation électronique. En chimie organique, il s'agit surtout d'électrons π et d'orbitales p, mais les orbitales d peuvent aussi participer dans les complexes de coordination et les composés organométalliques.
Exemples
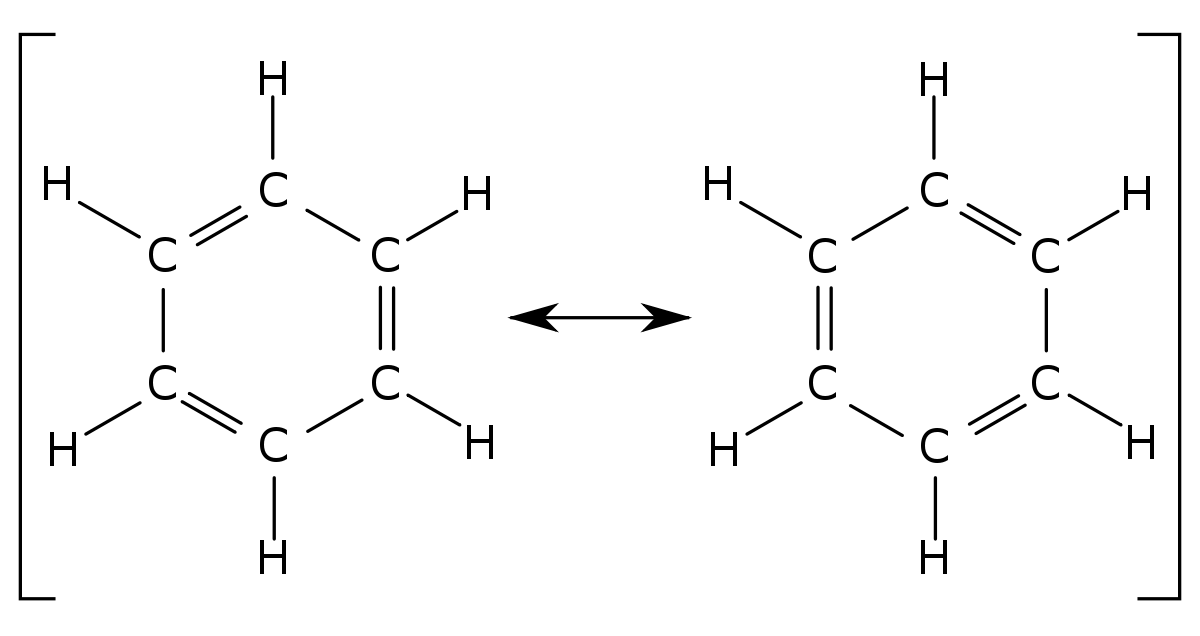
- Le benzène: Un exemple classique est donné par les formes de Kékulé du benzène. La molécule de benzène est fait d'un hexagone parfait d'atomes de carbone, avec 6 liaisons carbone-carbone identiques, et non une alternance de liaisons courtes (doubles) et de liaisons longues (simples), comme le laisseraient penser les deux formes limites prises séparément. Les deux mésomères majoritaires sont identiques et de même poids, et la longueur des liaisons C-C est intermédiaire entre celles d'une liaison simple et d'une liaison double.
- L'ion acétate: L'acidité beaucoup plus grande des acides carboxyliques par rapport à celle des alcools est explicable en partie par la mésomérie. Par déprotonation, un alcool donne un alcoolate dont la charge ne peut pas être délocalisée, alors qu'un acide carboxylique donne un carboxylate pouvant présenter des formes mésomères avec distribution de la charge négative sur les deux atomes d'oxygène, ce qui confère plus de stabilité. L'atome d'oxygène chargé porte trois doublets et agit en donneur π, alors que l'autre oxygène est accepteur π;. Ici aussi, les deux mésomères majoritaires sont identiques, ils ont le même poids et on peut alors correctement prédire que les liaisons carbone-oxygène seront identiques et de longueur intermédiaire entre celles d'une liaison simple et d'une liaison double (ce que l'on représente souvent par une deuxième liaison hachurée).
- Le radical allylique: Comme dans les cas de l'acétate et le benzène, les formes mésomères de ce radical sont identiques. Ce radical jouit d'une stabilité accrue, en comparaison avec d'autres, parce que l'électron solitaire est distribué et l'octet incomplet est partagé.
- Les énolates: Ces espèces sont les bases conjuguées des énols, qui bénéficient, comme l'acétate, d'une stabilisation par mésomérie. Par contre, les deux mésomères ne sont pas de poids égaux, étant donné la plus grande électronégativité de l'oxygène, et cette stabilisation n'est pas grande (les acidités des alcools et des énols sont plutôt voisines). Toutefois, la mésomérie sert à expliquer la réactivité ambidente des énolates, qui réagissent en tant que nucléophiles à l'oxygène ou au carbone, selon les conditions de la réaction.
- L'ion cyanate: La mésomérie dans ce cas explique sa réactivité ambidente, car cet ion peut donner lieu à des composés cyanates et isocyanates par réaction de l'azote ou de l'oxygène, selon les conditions.
- Les amides: L'azote, avec son doublet libre, est un donneur π et l'oxygène est accepteur π; (car sp2). Il en découle une double liaison partielle entre N et C, qui explique la rigidité de cette liaison vis-à-vis de la rotation (15 kcal/mol ou 60 kJ/mol environ de barrière énergétique), et une liaison C=O affaiblie, ce qui explique l'absorption en infrarouge par le groupement carbonyle à plus grande longueur d'onde par rapport à une cétone. Cette mésomérie explique aussi le fait que l'azote dans une amide est beaucoup moins basique que dans une amine, puisque son doublet est partiellement délocalisé, et que quand une amide réagit avec un électrophile, c'est l'atome d'oxygène qui agit en nucléophile.