Acide carboxylique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
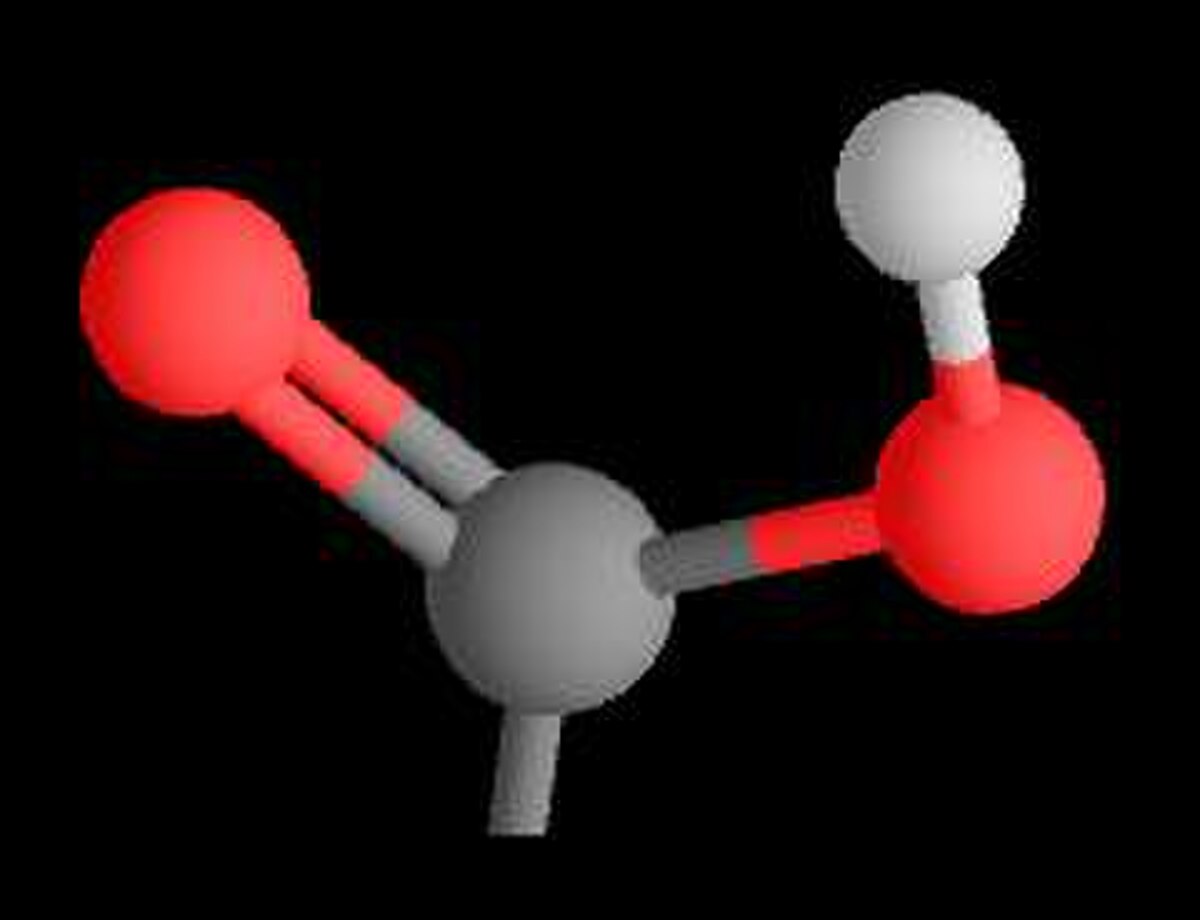
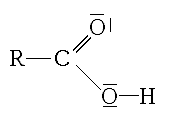
Le terme acide carboxylique désigne une molécule comprenant un groupement carboxyle (–C(O)OH) . Ce sont des acides et leurs bases conjuguées sont appelées carboxylates.
En chimie organique, un groupe carboxyle est un groupe fonctionnel composé d'un atome de carbone, lié par une double liaison à un atome d'oxygène et lié par une liaison simple à un groupe hydroxyle.
Généralités
En chimie, les acides carboxyliques R-COOH constituent avec les acides sulfoniques R-SO3H les deux types d'acides de la chimie organique. On les trouve de manière abondante dans la nature, sous la forme d'acide gras (lipide) et ils sont très importants en chimie industrielle. Par exemple, l'acide acétique est non seulement une brique importante pour les molécules complexes que l'on trouve en biologie, mais est aussi une molécule produite industriellement et qu'on retrouve dans le vinaigre. Un des plus connus est l'acide acétylsalicylique, plus connu sous le nom d'aspirine. La brique de base des protéines, les acides aminés sont des acides carboxyliques.
Le groupe fonctionnel caractéristique est le groupe carboxyle, ou R est un hydrogène ou un groupe organique :
Les acides carboxyliques ont pour formule brute CnH2nO2 lorsque le R est un groupe alkyle. Le calcul du nombre d'insaturation donne :
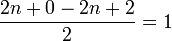
On écrit souvent les groupements carboxyles sous la forme réduite : -COOH (forme non ionisée du groupement). La forme ionisée du groupement est : -COO-.
Celui-ci est toujours situé en fin de chaîne carbonée. L'ajout d'un groupement carboxyle à un composé organique est une carboxylation, l'élimination de ce même groupement est une décarboxylation.
Ions carboxylates
Ce sont les bases conjuguées des acides carboxyliques. Ces bases sont en général plutôt faibles. La charge négative sur la molécule est délocalisée sur les deux atomes d'oxygène du groupe carboxyle par mésomérie, ce qui explique la stabilité relative de ce type de molécules.
Propriétés physiques et structurelles
État
Les acides carboxyliques sont liquides dans les conditions normales tant que leur chaine carbonée présente moins de 8 atomes de carbone. Ils sont solides au-delà.
Les acides de faible poids moléculaire possèdent une forte odeur, par exemple l'acide butanoïque est responsable de l'odeur du beurre rance.
Polarité, solubilité
La fonction acide carboxylique est fortement polaire et est à la fois donneur et accepteur de liaisons hydrogène. Ceci permet la création de liaisons hydrogène par exemple avec un solvant polaire comme l'eau, l'alcool, et d'autres acides carboxyliques.
De par cette propriété les acides carboxyliques de petite taille (jusqu'à l'acide butanoïque) sont complètement solubles dans l'eau. Les molécules d'acides sont aussi capables de former des dimères stables par pont hydrogène, ce qui permet d'expliquer pourquoi leur température d'ébullition est plus élevée que celle des alcools correspondants.
Acidité
En solution dans l'eau, l'acide se dissocie partiellement en ion carboxylate, selon l'équation-bilan :
Ce sont des acides faibles dans l'eau (pKA entre 4 et 5).
Comme les alcools, les acides carboxyliques montrent un caractère acide et basique : la déprotonation en ions carboxylates est facile, mais la protonation est plus difficile. Ils possèdent donc un pKA plus faible que celui des alcools. En fait l'acidité des acides carboxyliques s'explique par l'effet inductif dans le groupement carboxyle : la liaison C=O est très polarisée (électronégativité de l'oxygène supérieure à celle du carbone) ce qui fait que le carbone est électrophile, et il attire donc les électrons de l'autre oxygène. Or cet autre oxygène est lui-même lié à un hydrogène, et cette liaison est aussi polarisée, donc l'électron de l'hydrogène qui s'est rapproché de l'oxygène est attiré à son tour par le carbone électrophile. Cet hydrogène devient donc très facilement mobile, d'où l'acidité du groupement carboxyle.
La solubilité de l'acide carboxylique croit avec le pH.
Spectroscopie
En infra-rouge (IR) , l'acide carboxylique présente 2 bandes de valence :
| Vibration | C=0 | O-H |
|---|---|---|
| Nombre d'onde(cm-1) | 1680-1710 | 2500-3200 |
| Intensité | (forte) | large, moyenne a forte |
Structure
D'après la théorie VSEPR :
- la géométrie autour de l'atome de carbone (liaisons) est de type trigonale ;
- la géométrie autour de l'atome d'oxygène de la fonction carbonyle (liaison double + doublets libres) est aussi de type trigonale ;
- la géométrie autour de l'atome d'oxygène de la fonction hydroxyle (liaisons + doublets libres) est de type tétragonale (AX2E2).
L'acide carboxylique possède plusieurs formes mésomères.