Ornithine - Définition
La liste des auteurs de cet article est disponible ici.
| Ornithine | |
|---|---|
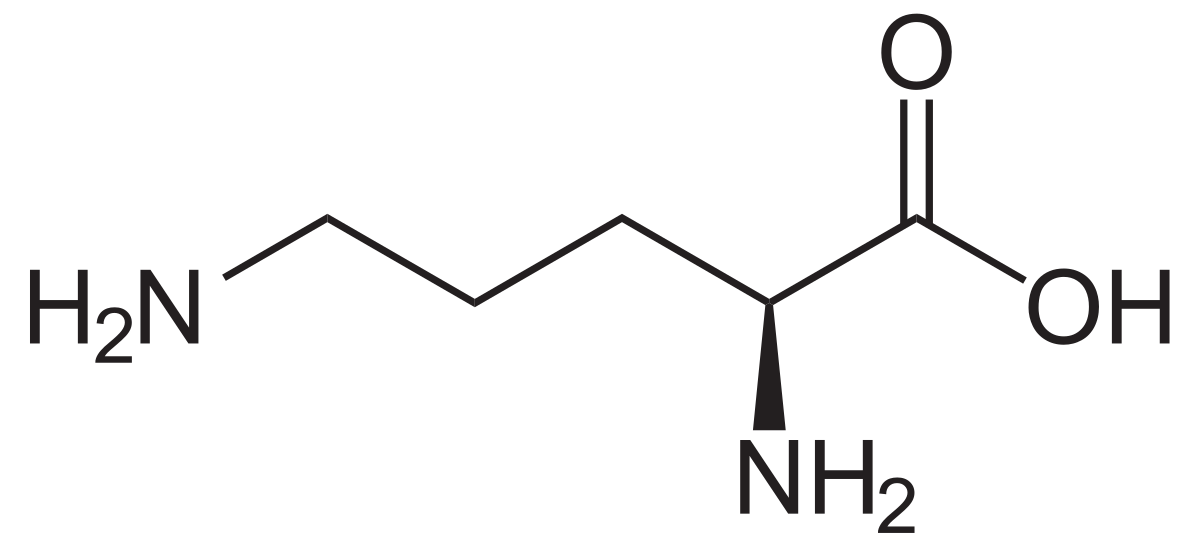
| |
| Général | |
| No CAS | |
| No EINECS | |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule brute | C5H12N2O2 |
| Masse molaire | 132,161 ± 0,0058 g·mol-1 |
| pKa | 1.94 (25 °C) |
| Propriétés physiques | |
| T° fusion | 140 °C |
| Propriétés biochimiques | |
| Acide aminé essentiel | dans certains cas |
| Précautions | |
| | |
| Produit non contrôlé | |
| | |
L'ornithine (acide 2,5-diaminopentanoïque) est un acide aminé non codé par le code génétique. À ce titre, il n'entre pas dans la composition des protéines.
L'ornithine est formée à partir du L-glutamate chez les plantes et de la L-arginine chez les animaux où elle apparait dans le cycle de l'urée.
- Chez les plantes, l'ornithine est un des précurseurs des alcaloïdes tropaniques. Ces derniers sont des esters d'alcools tropaniques et d'acides carboxyliques. L'ornithine est à l'origine du cycle pyrrolidinique du noyau de l'alcool tropanique.
- Chez les animaux, l'ornithine est un des produits de l'action de l'arginase dihydrolase sur la L-arginine pour former l'urée .
L'ornithine a un intérêt en microbiologie et en bactériologie. Cette molécule n'étant pas un acide aminé génétiquement codé, elle n'entre pas dans la constitution d'holoprotéines (qui ne sont constituées que de résidus d'acide aminé codé). Mais c'est une molécule qui peut être dégradée par des bactéries de façon à être utilisée par ces dernières. L'enzyme nécessaire à sa dégradation est l'ornithine décarboxylase donnant la putrescine plus du C0 (acide volatile moins acide que le groupement COOH, aussi appelé groupement carboxylique) ce qui provoque donc une alcalinisation du milieu.
Sachant que l'ornithine elle-même est synthétisée à partir de l'arginine grâce à l'enzyme argine dihydrolase qui donnent de la putrescine plus du CO, ce procédé est un peu complexe et emprunte deux voies possibles :
Dans tous les cas l'arginine est hydrolysée une première fois, donnant de la citrulline plus de l'ammoniac (NH).
Ensuite :
- soit la citrulline est à son tour hydrolysée et donne de l'ornithine, du CO et du NH ;
- soit il y a action du phosphate inorganique (Pi) qui forme alors de l'ornithine et du carbamyl-phosphate, qui a son tour subit l'action de l'ADP et forme de l'ATP plus du CO et du NH.

















































