Ammoniac - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Ammoniac | |||
|---|---|---|---|

| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | azane nitrure d'hydrogène esprit alcalin (volatil) | ||
| No CAS | |||
| No EINECS | |||
| SMILES | |||
| InChI | |||
| Apparence | gaz comprimé liquéfié, incolore, d'odeur âcre. | ||
| Propriétés chimiques | |||
| Formule brute | NH3 | ||
| Masse molaire | 17,0305 ± 0,0004 g·mol-1 | ||
| Moment dipolaire | 1,4718 ± 0,0002 D | ||
| Diamètre moléculaire | 0,310 nm | ||
| Propriétés physiques | |||
| T° fusion | -77,7 °C | ||
| T° ébullition | -33,35 °C | ||
| Solubilité | dans l'eau à 20 °C : 540 g·l-1 | ||
| Masse volumique | 0,7 g·cm-3 à -33 °C, 0,6813 (gaz) | ||
| T° d’auto-inflammation | 651 °C | ||
| Limites d’explosivité dans l’air | Inférieure : 15,5 (Weiss, 1985) Supérieure : 27 (Weiss, 1985) | ||
| Pression de vapeur saturante | à 26 °C : 1 013 kPa | ||
| Point critique | 112,8 bar, 132,35 °C | ||
| Thermochimie | |||
| S0 | 192,77 J/mol·K | ||
| ΔH0 | -39,222 kJ·mol-1 (-273,15 °C) -46,222 kJ·mol-1 (24,85 °C) | ||
| ΔH0 | -40,2 kJ/mol | ||
| ΔH° | 23,33 kJ·mol-1 (1 atm, -33,33 °C); 19,86 kJ·mol-1 (1 atm, 25 °C) | ||
| Cp | 2 097,2 J·kg-1·K-1 (0 °C) 2 226,2 J·kg-1·K-1 (100 °C) | ||
| PCI | 317,1 kJ·mol-1 | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 10,070 ± 0,020 eV (gaz) | ||
| Cristallographie | |||
| symbole de Pearson | cP16 | ||
| Classe cristalline ou groupe d’espace | P213 (n°198) | ||
| Strukturbericht | D1 | ||
| Structure type | NH3 | ||
| Propriétés optiques | |||
| Indice de réfraction |
| ||
| Précautions | |||
| | |||
| |||
| Phrases R : 10, 23, 34, 50, | |||
| Phrases S : 1/2, 9, 16, 26, 36/37/39, 46, 61, | |||
| | |||
| |||
| | |||
|
1 3 0 | |||
| | |||



| |||
| | |||




Danger | |||
| Inhalation | Les vapeurs sont très irritantes et corrosives | ||
| Peau | Les solutions concentrées peuvent provoquer des brûlures | ||
| Yeux | Dangereux, Irritation | ||
| Ingestion | L'ingestion peut provoquer des brûlures de la bouche, langue, œsophage | ||
| Écotoxicologie | |||
| Seuil de l’odorat | bas : 0,04 ppm haut : 53 ppm | ||
| | |||
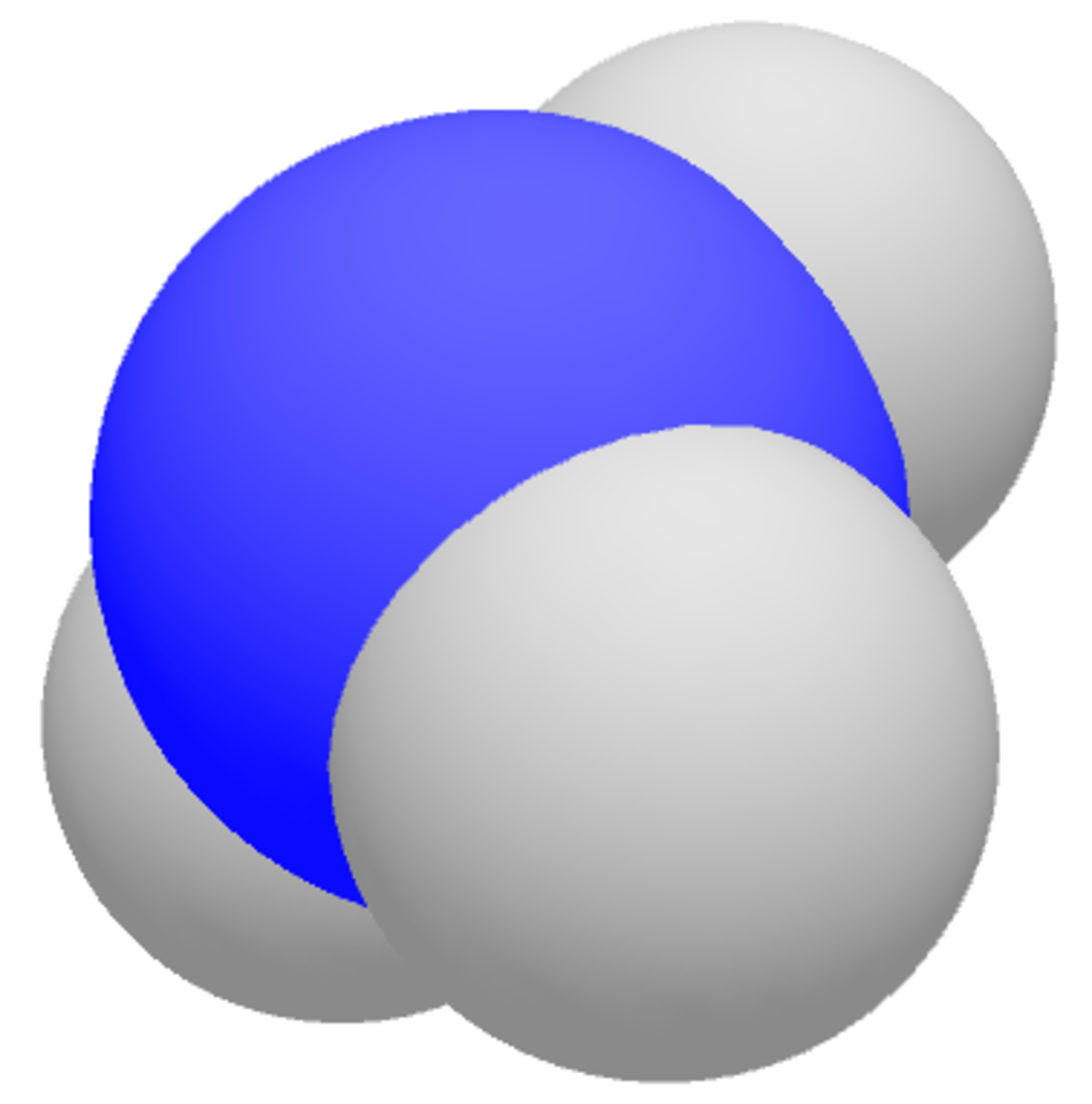
L’ammoniac est un composé chimique, de formule NH3 (groupe générique des nitrures d'hydrogène). C'est une molécule pyramidale à base trigonale : l'atome d'azote (N) est au sommet et les trois atomes d'hydrogène (H) occupent les trois coins (sommets) de la base triangulaire équilatérale. Plus précisément, l'atome d'azote « monte » et « descend » entre ce « sommet » de la pyramide et celui de la pyramide opposée, traversant ainsi la base triangulaire des atomes d'hydrogène. Cette « oscillation » s'effectue à une fréquence fondamentale de 24 GHz et a été mise à contribution dans les premières horloges atomiques.
Dans les conditions « ambiantes », il se présente sous la forme d'un gaz incolore (produisant une fumée de condensation à haute concentration) et dégageant une très désagréable odeur putride.