Protactinium - Définition
La liste des auteurs de cet article est disponible ici.
Historique
L'isotope 234Pa a été identifié en 1913 par Kasimir Fajans et Otto H. Göhring, qui l'avaient nommé « brévium » (bref).
Puis Otto Hahn et Lise Meitner ont découvert en 1918 le 231Pa, plus stable, en donnant à l'élément son nom actuel. Il n'a été isolé qu'en 1934.
Gisements
Le protactinium est présent en très faible quantité (typiquement de l'ordre de 1 ppm) dans les gisements naturels de minéraux uranifères (type pechblende), où il se forme lors de la lente décroissance radioactive de l'uranium. C'est un des plus rares et des plus coûteux des éléments naturels.
Propriétés
Parmi les 29 isotopes connus du protactinium, aucun n'est stable. Les plus stables sont 231Pa (demi-vie 32 760 ans), 233Pa (période 26,967 jours) et 230Pa (période 17,4 jours). Tous les autres isotopes ont des périodes inférieures à 1,6 jours. Cet élément possède également deux isomères peu stables, 217mPa (1,15 ms) et 234mPa (1,17 minutes).
Deux des isotopes du protactinium sont des produits intermédiaires situés en seconde position dans la chaîne de désintégration radioactive de l'uranium naturel :
- l'isotope 231 est issu de la désintégration β- du thorium 231 selon (
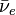
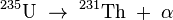
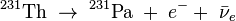
- l'isotope 234m est issu de la désintégration β- du thorium 234 selon :
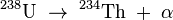
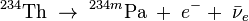
Du fait de son rayonnement alpha intense, le protactinium 231 est très radiotoxique par ingestion (0,71 μSv/Bq pour un adulte) et par inhalation (jusqu’à 140 μSv/Bq pour un adulte), soit des valeurs supérieures à celles du plutonium 238.
Composés
Composés chimiques connus du protactinium:
- Fluorures : PaF4 et PaF5
- Chlorures : PaCl4 et PaCl5
- Bromures : PaBr4 et PaBr5
- Iodures : PaI3, PaI4 et PaI5
- Oxydes : PaO, PaO2 et Pa2O5
Utilisation
La seule utilisation du protactinium est la recherche fondamentale.

















































