Isotope - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
En physique nucléaire et en chimie, deux atomes sont dits isotopes s'ils ont le même nombre de protons mais un nombre de neutrons différent. Le nombre de protons dans le noyau d'un atome est désigné par le numéro atomique Z. Deux isotopes ont le même nombre Z. Ce qui distingue deux isotopes est qu'ils ont un nombre de masse A différent. Le nombre de masse d'un atome est le nombre de nucléons que contient le noyau de cet atome. La différence de nombre de masse est donc due à une différence dans le nombre de neutrons N.
En mots plus simples, ce sont des atomes qui se différencient uniquement par leur nombre de neutrons, exception faite des cas d'ionisation (où on a aussi des nombres d'électrons différents).
Notation
Les isotopes sont désignés par leur symbole chimique, complété :
- par leur nombre de masse A (égal au nombre de nucléons de l'atome) placé en haut et à gauche du symbole, et
- par le numéro atomique Z, placé en bas et à gauche du symbole.
Le carbone 14, noté
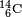
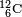
Les isotopes les plus courants de l'hydrogène sont également notés selon ce principe : 2H pour le deutérium et 3H pour le tritium ; l'UICPA admet toutefois (mais sans le recommander) l'usage respectivement des symboles D et T pour le deutérium et le tritium, en raison de l'effet isotopique marqué de ces isotopes par rapport au protium.
Stabilité
Il existe 80 éléments chimiques ayant au moins un isotope stable, de l'hydrogène 1H au plomb 82Pb, hormis le technétium 43Tc et le prométhium 61Pm qui n'ont aucun isotope stable.
Le noyau d'un atome est constitué de protons qui se repoussent sous l'action de l'interaction électromagnétique (les charges électriques de même nature se repoussent) mais qui s'attirent sous l'action de l'interaction forte ; il contient aussi des neutrons qui s'attirent sous l'action de l'interaction forte mais ne sont pas (très très peu) concernés par l'interaction électromagnétique. Dans un noyau, la stabilité est donc assurée par l'interaction forte, et par les neutrons qui, éloignant les protons les uns des autres par leur seule présence, diminuent l'interaction électromagnétique, d'où les propriétés suivantes :
Pour ces centaines d'isotopes naturels, les nombres respectifs de protons et de neutrons semblent respecter certaines règles :
- le nombre de neutrons est à peu près égal à celui des protons pour les éléments légers ; à partir du 21Sc, le nombre de neutrons devient supérieur au nombre de protons, l'excédent dépassant 50% pour les éléments les plus lourds ;
- certains noyaux particulièrement stables contiennent des protons ou des neutrons (ou les deux) égal à un des nombres (dit magiques) de la série :
- 2, 8, 20, 28, 50, 82, 126 ;
Pourquoi ces valeurs : Elles correspondent à des noyaux possédant des couches complètes de neutrons ou de protons. Les règles de couches pleines sont assez simples et assez semblables à celles des couches d'électrons Pour retrouver ces valeurs on considère les couches successives du centre vers la périphérie du noyau : s1/2 p3/2 1/2 d5/2 3/2 f7/2 5/2 g9/2 7/2 h11/ 9/2.
Les règles :
Le niveau s contient 1+ 1/2.2 protons et ou neutrons soit 2 et constitue la première couche.
Le niveau p en contient 1+ 3/2.2+1+1/2.2 soit 6 à ajouter à la couche s soit 6+2= 8.
La troisième couche contient les niveaux s et d on trouve facilement 10 à ajouter à 8 soit 20.
La quatrième couche contient les niveaux p et f soit 20 ce qui devrait faire 20+20= 40 mais le potentiel crée par le centre du noyau fait que le premier élément du niveau g est proche de la 4e couche et il faut ajouter à cette couche g9/2 soit 10 nucléons ainsi la 4e couche se trouve pour 50 nucléons.
La cinquième couche comporte les niveaux s d g (amputé du g 9/2) et ajouté du h11/2 soit 76 ajouté au 50 précédent fait un total de 126. On y trouve notamment le plomb dont l'isotope le plus stable contient 82 protons et 126 neutons. Il est doublement magique. la valeur suivante est 184.
Ce sont des noyaux sphériques. Entre ces valeurs se trouvent des noyaux déformés en cigare ou en soucoupe, moins stables. Le noyau à 126 protons n'a pas pu être créé encore ; il sera instable sans doute mais on approche de cette valeur en combinant 2 atomes.
- les éléments de nombre Z impair possèdent moins d'isotopes stables que les éléments de nombre Z pair.

















































