Tris - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
Introduction
| Tris | ||
|---|---|---|
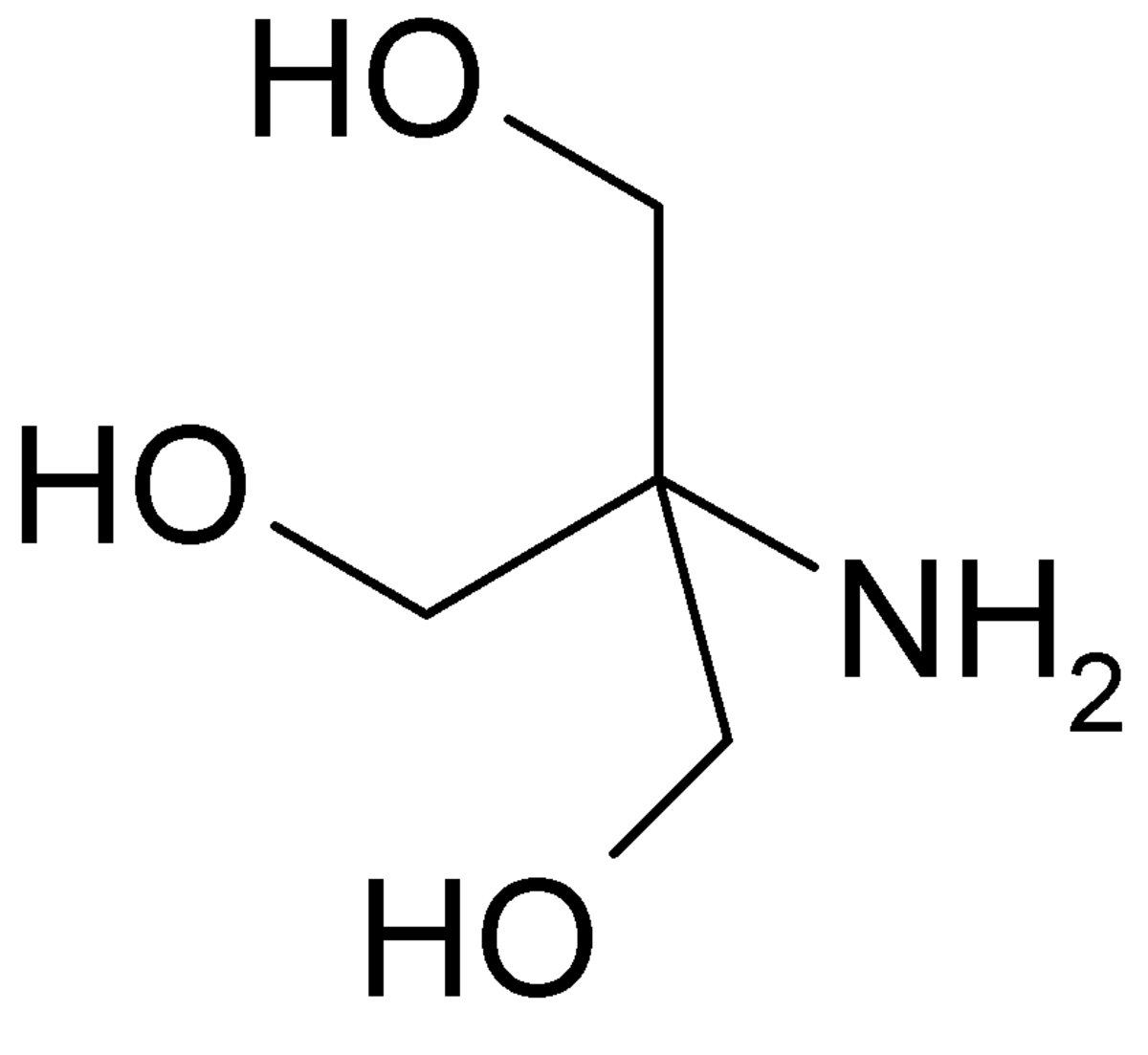
| ||
| Général | ||
| Nom IUPAC | ||
| Synonymes | TRIS, Tris, Tris base, Tris buffer, Trizma(TM), Trisamine, THAM, Trométhamine, Trométamol, Trométhane | |
| No CAS | ||
| No EINECS | ||
| No RTECS | ||
| SMILES | ||
| Apparence | Poudre cristalline blanche | |
| Propriétés chimiques | ||
| Formule brute | C4H11NO3 | |
| Masse molaire | 121,135 ± 0,0051 g·mol-1 | |
| pKa | 8.3 | |
| Propriétés physiques | ||
| T° fusion | >170 °C | |
| T° ébullition | 219 °C | |
| Solubilité | 670 g·l-1 (eau, 20 °C) | |
| Point d’éclair | Non-inflammable | |
| Précautions | ||
| | ||
| ||
| Phrases R : 36, 37, 38, | ||
| Phrases S : 26, 36, | ||
| | ||
|
0 2 0 | ||
| | ||

| ||
| | ||
Tris est l'abréviation courante de trishydroxyméthylaminométhane, ou 2-amino-2-hydroxyméthyl-1,3-propanediol selon la nomenclature chimique internationale. Il est largement utilisé comme tampon en biochimie, particulièrement pour travailler avec des acides nucléiques avec un intervalle de pH entre 6.5 et 9.7. Le tris possède des protons labiles, avec un pKa de 8.30 (à 20 °C; le pKa diminue ensuite de 0.03 unités par élevation d'un 1 degré Celsius de température).
Usages
Le tris est utilisé comme intermédiaire pour la préparation d'agents de surface actifs, accélérateur de la vulcanisation, pour la préparation d'agents pharmaceutiques, ou comme standard titrimétrique.
Désavantages
- La dissociation est affectée par la température (cf. supra)
- Toxique pour les cellules de mammifères
- Forte réaction avec les électrodes mesurant le pH
- Forte réaction avec les amines primaires



















































