Acide perchlorique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| acide perchlorique | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| Apparence | liquide incolore, d'odeur acre | ||
| Propriétés chimiques | |||
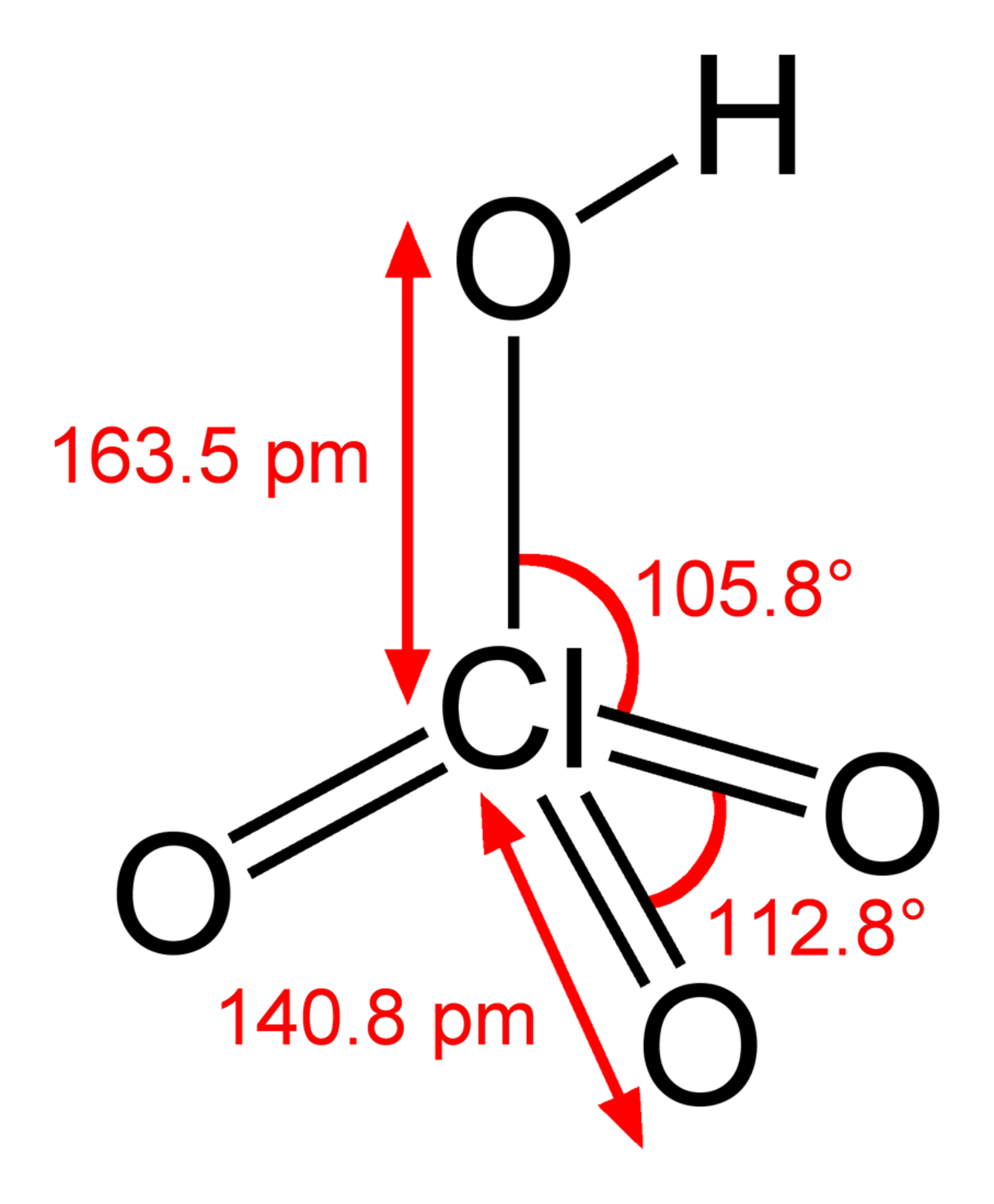
| Formule brute | HClO4 | ||
| Masse molaire | 100,459 ± 0,003 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | -112 °C | ||
| T° ébullition | (décomposition) : 19 °C | ||
| Solubilité | dans l'eau : miscible | ||
| Masse volumique | (eau = 1) : 1.76 à 22 °C | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 5, 8, 35, | |||
| Phrases S : (1/2), 23, 26, 36, 45, | |||
| | |||
| |||
| | |||
|
0 3 3 OX | |||
| | |||



| |||
| | |||


Danger | |||
| | |||
L'acide perchlorique est un oxacide à base de chlore VII de formule HClO4.
Description
C'est un liquide incolore, un acide fort et un oxydant fort. Ses sels sont appelés les perchlorates. C'est la seule forme du chlore stable vis à vis de la dismutation en milieu basique avec l'ion chlorure. Il peut être deshydraté en anhydride perchlorique Cl2O7 très instable.
Utilisations
Les perchlorates sont des composés importants en pyrotechnie en tant que transporteur d'oxygène dans les mélanges. L'acide perchlorique peut être utilisé comme contre ions en solution car la majorité de ses sels sont solubles dans l'eau ce qui limite les problèmes de précipitation.
Synthèse
On synthétise les ions perchlorates par oxydation électrochimique des ions chlorates et on obtient l'acide par action de l'acide sulfurique sur ses sels.