Déplacement d'équilibre - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Dans de nombreuses synthèses chimiques, l'un des principaux buts est d'améliorer le rendement. Lorsque ces synthèses sont des équilibres, comme par exemple dans le cadre de l'estérification, on cherche à déplacer ces équilibres de manière à augmenter le rendement. Ici sont réunies les principales lois qui régissent ces déplacements d'équilibres.
Définitions
Soit un système physico-chimique dans un état d'équilibre. Si on lui impose une variation d'un seul paramètre intensif, il y a en général évolution vers un nouvel état d'équilibre.
- Si l'état final est un état d'équilibre du même système physico-chimique que l'état initial (même espèces chimiques, dans le même état physique), on parle de déplacement d'équilibre.
- Si l'état final est un état d'équilibre d'un système physico-chimique différent, on parle de rupture d'équilibre.
Influence de la température : Loi expérimentale de Van't Hoff
On se place à volume ou à pression constant, en système fermé.
Énoncé
« Une élévation de température appliquée à un système fermé en équilibre et maintenu à pression ou à volume constant entraîne un déplacement voire une rupture d'équilibre dans le sens de la réaction qui, à température et pression ou volume constants, est endothermique. »
En pratique
Si un système fermé en équilibre subit une élévation de température, une réaction chimique endothermique verra sa réaction directe favorisée et une réaction chimique exothermique verra sa réaction inverse favorisée. Il s'agit d'une particularisation du principe de Le Chatelier.
Exemple
Soit l'équation chimique de combustion de l'éthanol :
- CH3CH2OH + 3 O2 → 2 CO2 + 3 H2O
Si la température augmente, l'équilibre chimique va être déplacé dans le sens de la réaction endothermique. Comme une réaction de combustion est toujours exothermique, l'équilibre chimique sera déplacé vers la gauche, donc vers O2 et CH3CH2OH. La constante d'équilibre de la réaction va diminuer et le système va s'adapter à cette nouvelle valeur.
Démonstrations
Un système subit une variation de température dT (dT > 0 : le système est chauffé)
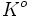
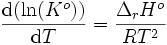
Avec  . Donc
. Donc
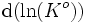
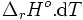
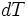
 ,
,  , donc K°, la constante d'équilibre, est croissante avec la température T. Pour une réaction exothermique, c'est l'inverse, elle est décroissante, ce qui est cohérent avec les résultats expérimentaux.
, donc K°, la constante d'équilibre, est croissante avec la température T. Pour une réaction exothermique, c'est l'inverse, elle est décroissante, ce qui est cohérent avec les résultats expérimentaux.L'affinité chimique s'écrit:
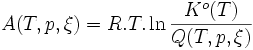
Or quand on passe d'un état 1 à un état 2,
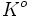
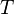
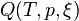
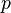
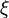
d'une part:
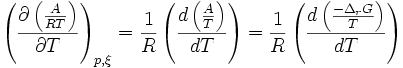
Or d'après la relation de Gibbs-Helmholtz:
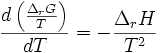
donc
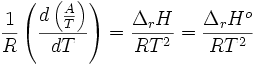
D'autre part:
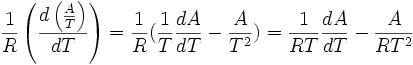
on choisit
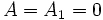
donc
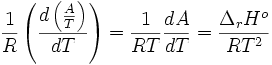
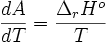
donc
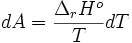
D'après la condition d'évolution naturelle  donc
donc  car
car  et comme on considère
et comme on considère 
 ⇒
⇒ 
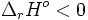
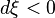
Loi générale de modération : Principe de Le Chatelier
Le principe de Le Chatelier, ou loi générale de modération, déduite d'observations expérimentales, a été énoncé par Henry Le Chatelier en 1884. Ce principe est applicable dans le cadre d'un déplacement d'équilibre, et non pas d'une rupture d'équilibre.
Énoncé :
« Lorsque les modifications extérieures apportées à un système physico-chimique en équilibre provoquent une évolution vers un nouvel état d'équilibre, l'évolution s'oppose aux perturbations qui l'ont engendrée et en modère l'effet. »
Ce genre de principe existe aussi en électromagnétisme, dans le domaine de l'induction connu sous le nom de loi de Lenz.
Autres formulations:
- Un système thermodynamique en équilibre soumis à une perturbation (introduction d'un nouveau constituant, variation de la pression, variation de la température, etc) tend à s'opposer à cette perturbation, le déplacement de l'équilibre tendant à restituer les conditions initiales.
- Si un système chimique à l’équilibre est soumis à une modification de certains paramètres ayant pour effet de perturber cet équilibre, ledit système évolue dans la direction qui contrecarre la modification imposée, de manière à se réajuster à un nouvel état d’équilibre caractérisé par la même valeur de constante thermodynamique.
Ce principe se déduit de la loi d'action de masse et de la loi de van 't Hoff.