Hydrogénopersulfate de potassium - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Hydrogénopersulfate de potassium | |||
|---|---|---|---|
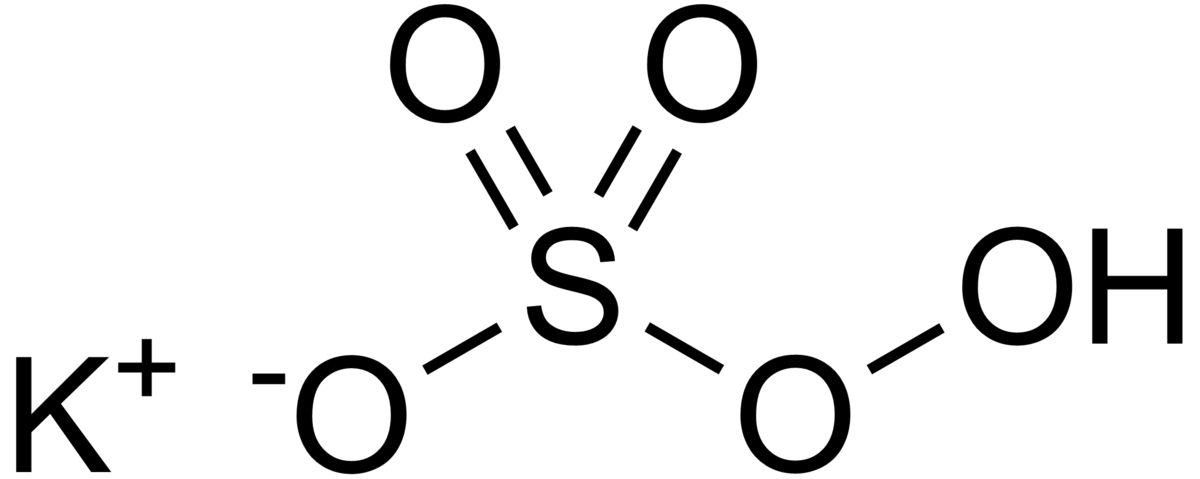
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | peroxymonosulfate de potassium monopersulfate de potassium MPS Caroat Oxone | ||
| No CAS | et (sel triple - voir le texte) | ||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule brute | KHSO5 | ||
| Masse molaire | 152,168 ± 0,007 g·mol-1 | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 8, 34, 37, | |||
| Phrases S : 17, 36/37/39, | |||
| | |||
| |||
| | |||
L'hydrogénopersulfate de potassium ou peroxymososulfate de potassium (aussi connue sous l'abbréviation MPS et les noms de marque Caroat® et Oxone®) est le sel de potassium de l'acide persulfurique. Il est largement utilisé comme agent d'oxydation en chimie organique.
Ce sel est commercialisé par deux compagnies : Evonik (auparavant Degussa) sous le nom de marque Caroat® et DuPont sous le nom d'Oxone®, nom de marque qui maintenant est devenu un mot commun dans le vocabulaire de la chimie. Ces produits sont, de fait, le sel triple de formule 2KHSO5·KHSO4·K2SO4, MM = 614.76 g/mol. Le potentiel standard (E0) pour ce sel triple est de 1,85 V pour la demi-réaction qui génère l'ion hydrogénosulfate:
- HSO5– + 2 H+ + 2 e– → HSO4– + H2O E0 = 1,85 V
Reactions
L'oxone est un oxydant versatile. Il oxyde les aldéhydes en acides carboxyliques, en présence de solvants alcooliques, les esters peuvent être obtenus. Les alcènes internes peut être clivés pour donner deux acides carboxyliques tandis que les alcènes terminaux sont epoxydés. Les thioéthers donnent des sulfones, les amines tertiaires des amine oxyde et les phosphines des phosphine oxydes (en).
Une illustration du pouvoir oxydant de ce sel est la conversion d'un dérivé de l'acridine en l'acridine-N-oxyde correspondant:
Il oxyde aussi un thioéther en sulfone avec deux équivalents et avec une seul équivalent, la réaction s'arrête au stade sulfoxyde car la réaction qui convertit la sulfure en sulfoxyde est beaucoup plus rapide que la réaction qui convertit le sulfoxyde en sulfone. Il est ainsi possible d'arrêter facilement la réaction au stade désiré :



















































