Acridine - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Acridine | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | 9-azaanthracène, benzo[b]quinoléine | ||
| No CAS | |||
| No EINECS | |||
| SMILES | |||
| InChI | |||
| Apparence | Solide blanc | ||
| Propriétés chimiques | |||
| Formule brute | C13H9N | ||
| Masse molaire | 179,2173 ± 0,0112 g·mol-1 | ||
| pKa | 5,6 | ||
| Propriétés physiques | |||
| T° fusion | 107 °C | ||
| T° ébullition | 346 °C | ||
| Précautions | |||
| | |||
| |||
| | |||
| |||
| | |||
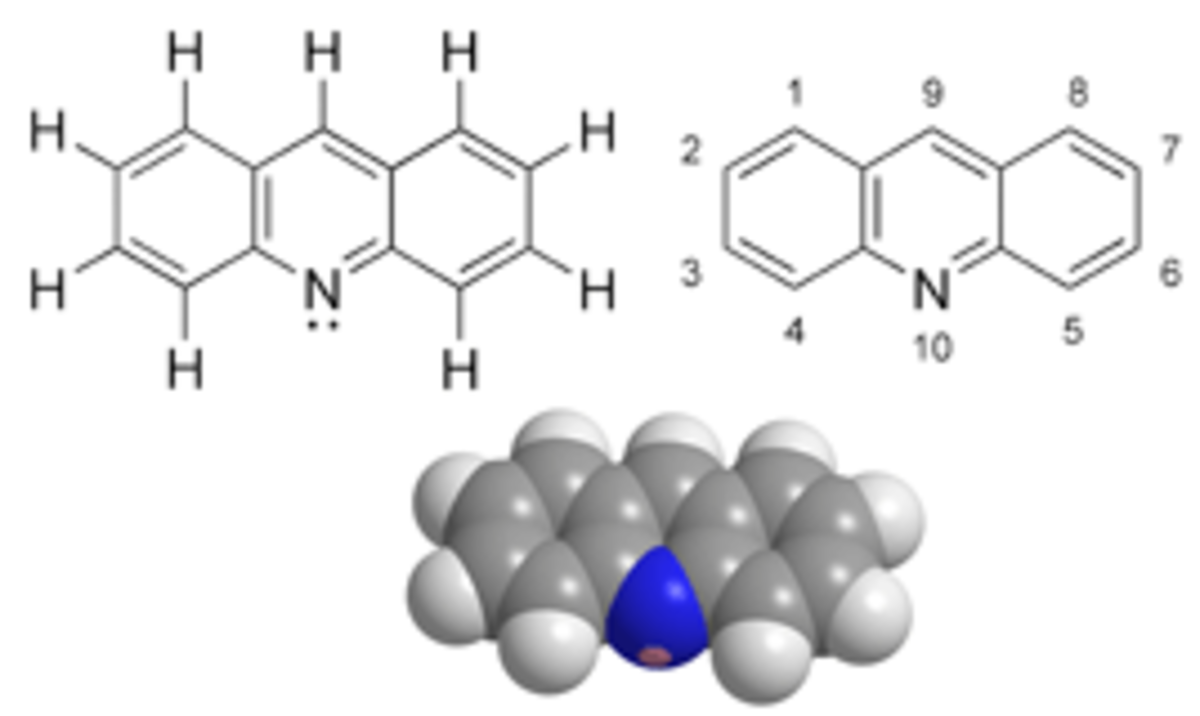
L'acridine, de formule chimique C13H9N, est un hétérocycle azoté. Le nom désigne aussi les composés contenants le cycle triple C13N. Elle est apparentée structurellement à l'anthracène, dont on aurait remplacé un des groupes CH centraux par un azote. Elle a été originellement isolée de la houille.
C'est une matière première utilisée pour la production de pigments et de quelques médicaments. De nombreuses acridines, comme la proflavine, ont aussi une activité antiseptique. L'acridine et ses dérivés se lient à l'ADN et à l'ARN, grâce à leurs propriétés d'intercalation. L'acridarsine est formellement dérivée de l'acridine par le remplacement de l'atome d'azote par un atome d'arsenic, et l'acridophosphine par un atome de phosphore.
Historique
L'acridine a été isolée pour la première fois en 1871 par Carl Gräbe et Heinrich Caro.
Propriétés physiques
L'acridine et ses homologues sont des composés stables, faiblement basiques (pKa = 5,6, comparable à la pyridine). Elle partage des propriétés avec la quinoléine. L'acridine cristallise sous forme d'aiguilles qui fondent à 110 °C. C'est un irritant de la peau. Ses sels donnent une fluorescence bleue en solution.
Synthèse
L'acridine existe naturellement dans la houille. Elle est extraite par l'acide sulfurique dilué. L'addition de dichromate de potassium précipite le bichromate d'acridinium. Celui-ci libère l'acridine par réaction avec l'ammoniaque.
De nombreux procédés synthétiques permettent l'accès à l'acridine et à ses dérivés. Par exemple, A. Bernthsen condense la diphénylamine avec des acides carboxyliques en présence de chlorure de zinc. Avec l'acide formique, on obtient l'acridine. Avec les homologues, on obtient des dérivés substitués en position méso.
D'autres méthodes plus anciennes incluent la condensation de la diphénylamine avec le chloroforme en présence de chlorure d'aluminium, la réaction en phase gaz d'orthoaminodiphénylméthane, le chauffage d'acide salicylique avec l'aniline et le chlorure de zinc à 260 °C, ou la distillation de l'acridone en présence de zinc en poudre.
Une méthode générale est la cyclisation d'acide N-phénykanthranilique ou d'acide 2-(phénylamino)benzoïque avec l'acide phosphorique.
Sécurité
L'acridine est un cancérigène connu chez l'homme. Il cause des mutations en s'incorporant dans l'ADN, en créant de ce fait une nouvelle base sur le brin opposé. Si cette mutation apparaît dans un gène codant, cela inactive quasiment toujours la protéine.