Oxyde de carbone - Définition
La liste des auteurs de cet article est disponible ici.
Dioxydes de carbone linéaires
Une des familles d'oxydes de carbone a la formule générale CnO2, ou O=(C=)nO, c'est-à-dire qu'il s'agit d'une chaîne linéaire d'atomes de carbone sp2 chapeautée à chaque bout par un atome d'oxygène. Les premiers composés sont les suivants :
- CO2 ou O=C=O, le dioxyde de carbone ;
- C2O2 ou O=C=C=O, l'extrêmement instable éthènedione ;
- C3O2 ou O=C=C=C=O, le métastable suboxyde de carbone ou dioxyde de tricarbone ;
- C4O2 ou O=C=C=C=C=O, le dioxyde de tétracarbone ou la butatriène-1,4-dione ;
- C5O2 ou O=C=C=C=C=C=O, le dioxyde de pentacarbone, stable en solution à température ambiante et pur jusqu'à -90 °C.
Des membres de cette famille ont été détectés à l'état de trace dans des expériences en phase gazeuse à basse pression ou en matrice cryogénique, spécifiquement pour n = 7 et pour n = 17, n = 19 et n = 21.
Structure générale
Habituellement, le carbone est tétravalent, tandis que l'oxygène est divalent et dans la plupart des oxydes de carbone comme dans la plupart des composés du carbone, l'atome de carbone peut alors être lié à quatre autres atomes, tandis que l'atome d'oxygène ne peut être lié au plus qu'à deux atomes. De plus, tandis que le carbone peut former des chaînes arbitrairement longues ou des réseaux, les chaînes de trois oxygènes consécutifs ou plus sont rarement, sinon jamais, observées. Ainsi les oxydes de carbone électriquement neutres connus consistent en un ou plusieurs squelettes carbonés, incluant les structures cycliques et aromatiques, connectés et clos par des groupes oxo, -O- ou =O, et peroxo, -O-O-.
Des atomes de carbone non tétravalents mais divalents sont trouvés dans certains oxydes, comme les biradiraux, monoxyde de carbone, CO ou :C=O, monoxyde de dicarbone, C2O ou :C=C=O, et monoxyde de tricarbone, C3O ou :C=C=C=O, mais à part le premier, ces oxydes sont généralement trop réactifs pour être séparés en quantité. La perte ou le gain d'électrons peut produire des oxygènes chargés négativement et monovalents, –O–, des oxygènes chargés positivement et trivalents, ≡O+ ou encore des atomes de carbone chargés négativement et trivalents, ≡C–. Ces deux dernières formes se rencontrent dans le monoxyde de carbone, –C≡O+ alors que les atomes d'oxygène chargés négativement apparaissent dans les oxocarbones anioniques (en).
Polycétones cycliques de type radialène
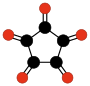
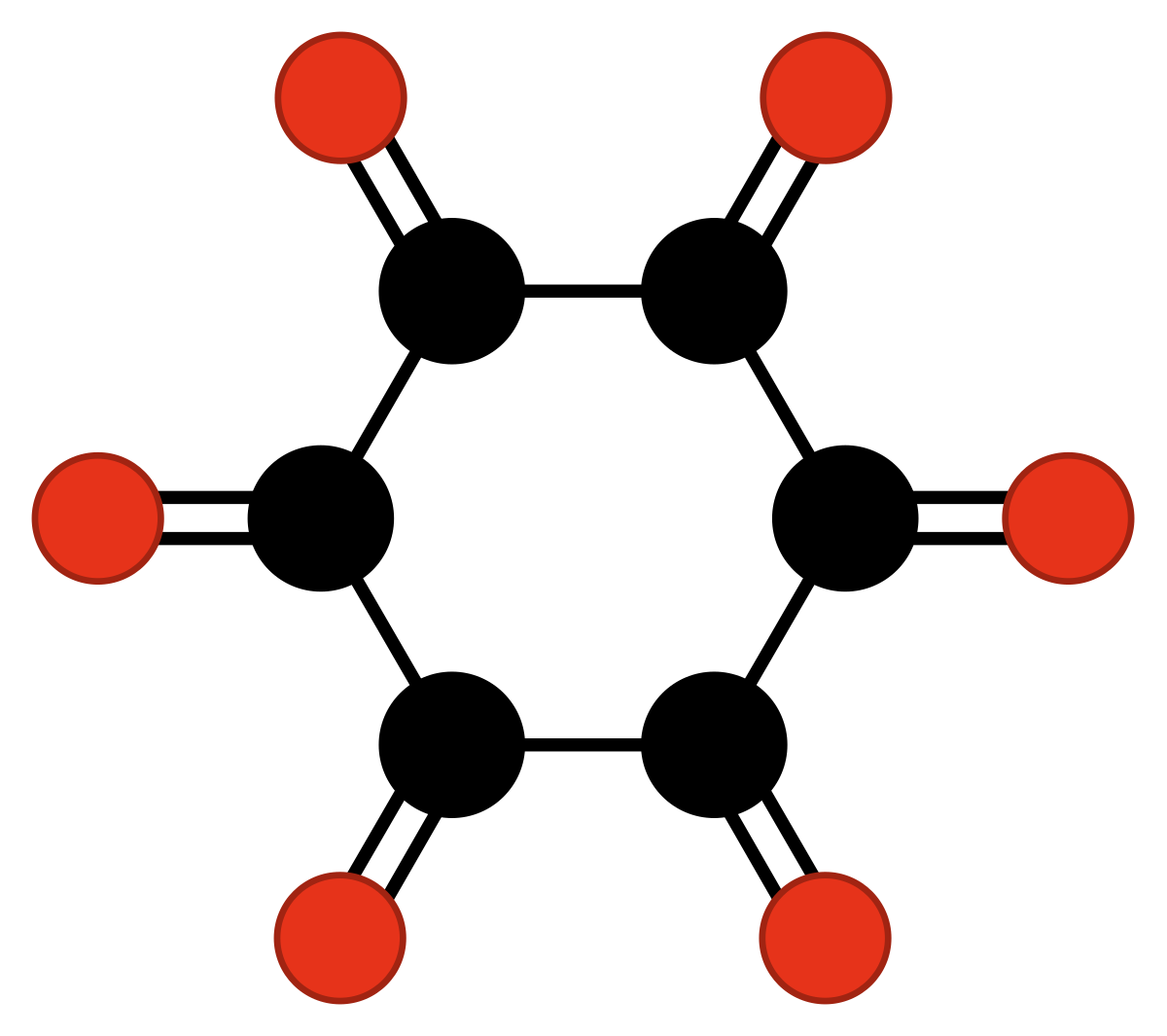
Une autre famille d'oxydes de carbone méritant une attention spéciale est celle des oxydes de carbone cycliques de type radialène de formule générale CnOn ou (CO)n. Ils peuvent être vus comme étant des oligomères cycliques du monoxyde de carbone ou comme des n-uples cétones de cycloalcanes à n carbones. Le monoxyde de carbone peut être vu comme le premier composé de cette famille (n = 1). Des études théoriques indiquent que l'éthènedione, C2O2 ou O=C=C=O, et la cyclopropanetrione, C3O3, ne peuvent exister. Les trois composés suivants, C4O4, C5O5 et C6O6 sont théoriquement possibles mais probablement peu stables et jusqu'à maintenant, ils n'ont été synthétisés qu'en minuscules quantités.

|

|
|
|
| (CO)3 cyclopropane- trione | (CO)4 cyclobutane- tétrone | (CO)5 cyclopentane- pentone | (CO)6 cyclohexane- hexone |
D'un autre côté, les anions de ces oxydes de carbone sont relativement stables et certains d'entre eux sont connus depuis le XIXe siècle :
| Formule chimique | Nomenclature IUPAC | Chimiste(s) | Année de la découverte |
|---|---|---|---|
| C2O22– | éthynediolate | Bücher & Weiss | 1963 |
| C3O32– | deltate | Eggerding & West | 1976 |
| C4O42– | squarate | Cohen & al. | 1959 |
| C5O52– | croconate | Gmelin | 1825 |
| C6O62– | rhodizonate | Heller | 1837 |
L'oxyde cyclique C6O6 forme aussi les anions stables de la tétrahydroxybenzoquinone (C6O64–) et du hexahydroxybenzène (C6O66–). L'aromaticité de ces anions a été étudiée par des méthodes théoriques.

















































