Oxyde de carbone - Définition
La liste des auteurs de cet article est disponible ici.
Monoxydes de carbone linéaires
Les monoxydes de carbone linéaires, CnO, forment une autre famille d'oxydes de carbone. Son premier membre, le monoxyde de carbone, CO, semble être le seul qui soit stable à l'état pur et à température ambiante. La photolyse des dioxydes de carbone dans une matrice cryogénique induit la perte d'une unité CO, entraînant des quantités détectables de monoxydes avec n pair comme C2O, C4O et C6O. Les composés jusqu'à n = 9 ont aussi été obtenus par décharges électriques sur du suboxyde de carbone dilué dans de l'argon. Les trois premiers composés de cette famille ont été détectés dans le milieu interstellaire.
Quand n est pair, les molécules sont censées être dans un état triplet du type cumulène, avec tous les atomes connectés avec des doubles liaisons et une orbitale moléculaire vide sur le premier carbone comme dans :C=C=O, :C=C=C=C=O et, en général, :(C=)2m=O. Quand n est impair, la structure triplet (radicalaire) est estimée en résonance avec un état singulet du type acétylène, polaire avec une charge négative sur le carbone terminal et une charge positive sur l'oxygène à l'autre bout comme dans –C≡C-C≡O+, –C≡C-C≡C-C≡O+ et, en général, –(C≡C-)2mC≡O+. Le monoxyde de carbone suit cette tendance : sa forme prédominante est considérée comme étant –C≡O+.
Oxydes de carbone polymériques
Le suboxyde de carbone polymérise spontanément à température ambiante en polymère carbone-oxygène de ratio atomique 3:2. Le polymère est considéré comme une chaîne linéaire de lactones, à 6 atomes, fusionnées, avec une ossature continue de carbone constituée d'une alternance de liaisons simples et doubles. Des mesures physiques indiquent que le nombre moyen d'unités par molécule est d'environ 5-6, dépendant de la température de formation.

1 |
2 |
3 |

4 |
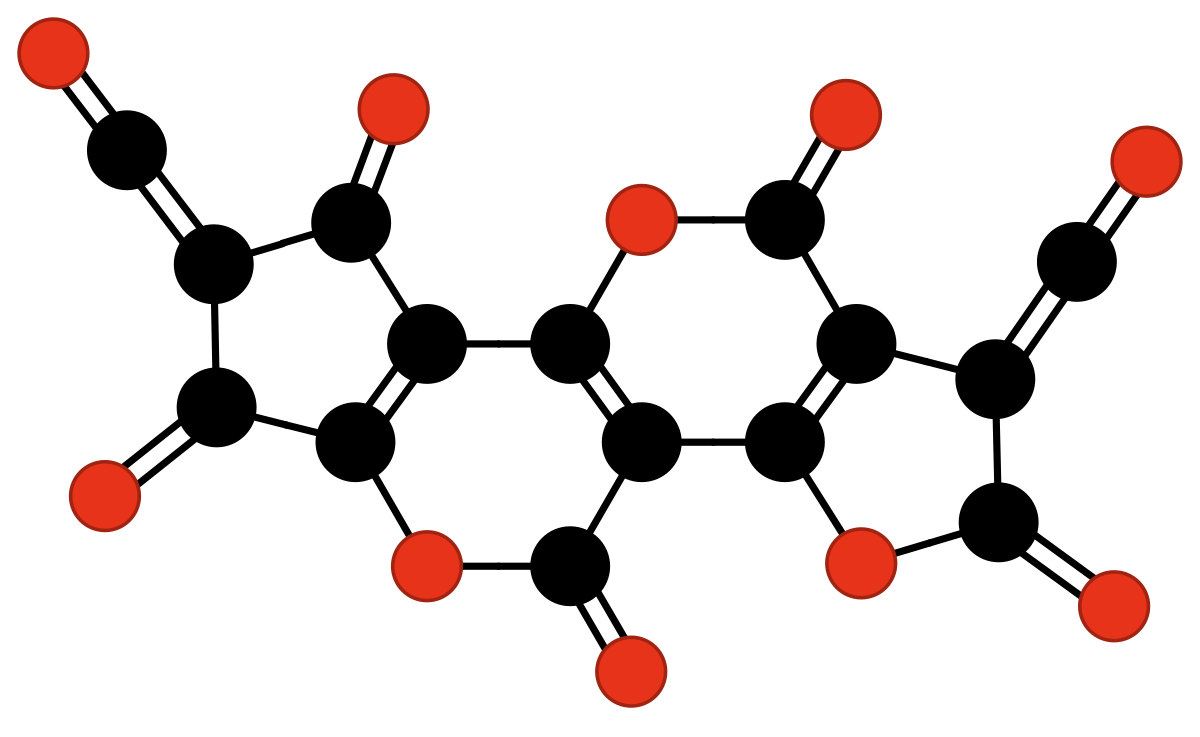
| Unités de terminaison et de constitution du C3O2 polymérique. À noter que les unités 1 et 4 et, identiquement, 2 et 3 sont identiques (sous différents angles,sur la figure) et donc que deux unités chimiques suffisent pour décrire les oligomères et polymères de C3O2. | |||

|

|
|

|
| Oligomères de C3O2 de 3 à 6 unités. | |||
En comprimant du monoxyde de carbone à 5 GPa dans une cellule à enclumes de diamant, un polymère rougeâtre assez similaire avec une teneur en oxygène légèrement plus élevée est obtenu. Il est métastable à température et pression ambiantes. Le CO dismuterait dans la cellule, créant un mélange de CO2 et de C3O2, ce dernier formant un polymère similaire à celui obtenu par polymérisation spontanée du C3O2, décrit ci-dessus, mais avec une structure plus irrégulière et qui piège en son sein une partie du CO2.
Un autre polymère carbone-oxygène avec un ratio C:O de 2:1 ou plus, est le classique oxyde de graphite et sa version monocouche, l'oxyde de graphène.
Nouveaux oxydes de carbone
Beaucoup de nouveaux oxydes de carbone stables ou métastables ont été synthétisés depuis les années 1960 comme (dans l'ordre chronologique) :
| Formule | Nomenclature IUPAC | Commentaire | Découverte | Formule dévelopée (image) | |
|---|---|---|---|---|---|
| Chimiste | Année | ||||
| C10O8 | dianhydride 1,4-benzoquinonetétracarboxylique | Hammond | 1963 |
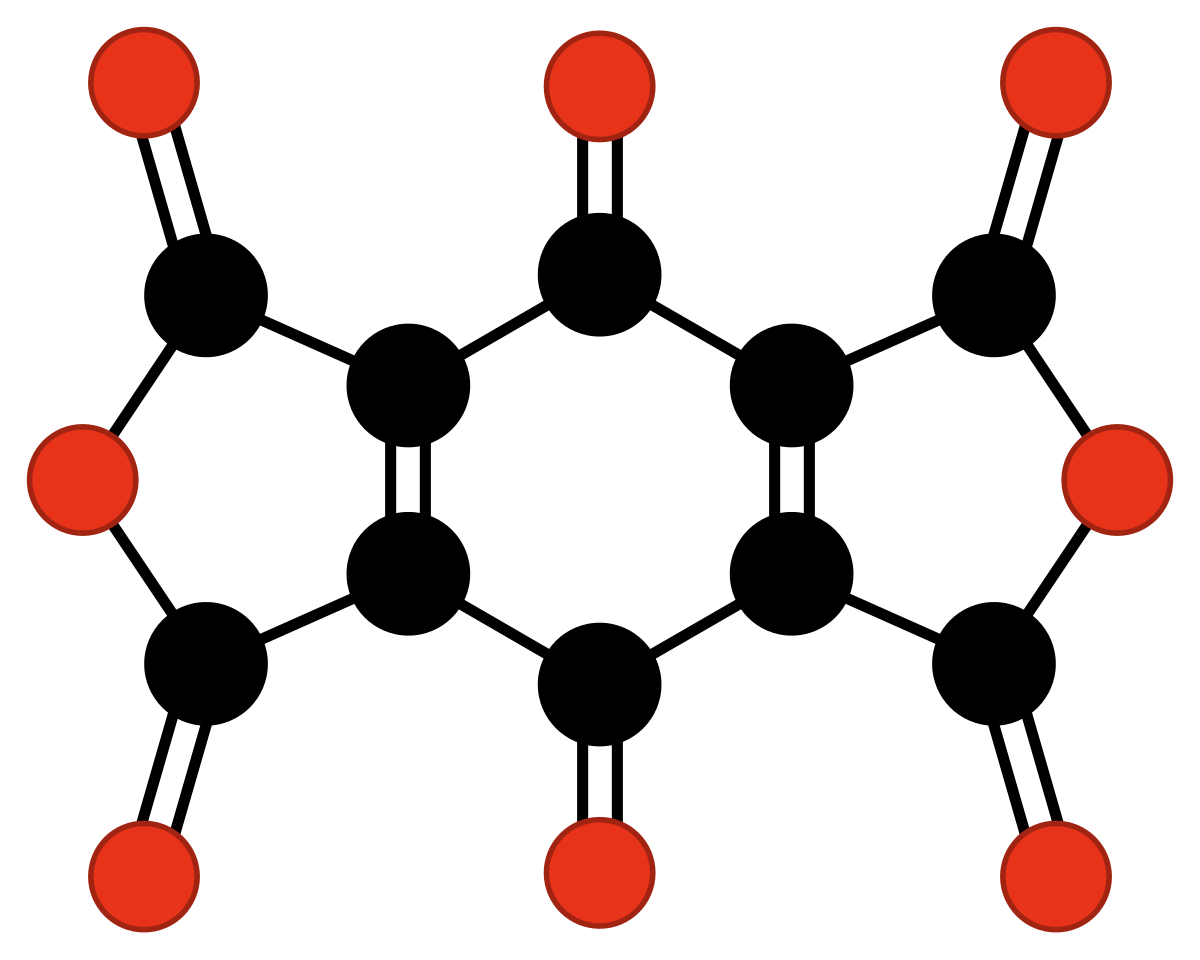
| |
| C6O6 | dianhydride éthylènetétracarboxylique | isomère stable de la cyclohexanehexone. | Sauer & al. | 1967 |
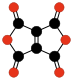
|
| C12O12 ou C6(C2O4)3 | trisoxalate d'hexahydroxybenzène | stable sous forme de solvate de tétrahydrofurane. | Verter & Dominic | 1967 |

|
| C10O10 ou C6O2(C2O4)2 | bisoxalate de tétrahydroxy-1,4-benzoquinone | stable sous forme de solvate de tétrahydrofurane. | Verter & al. | 1968 |
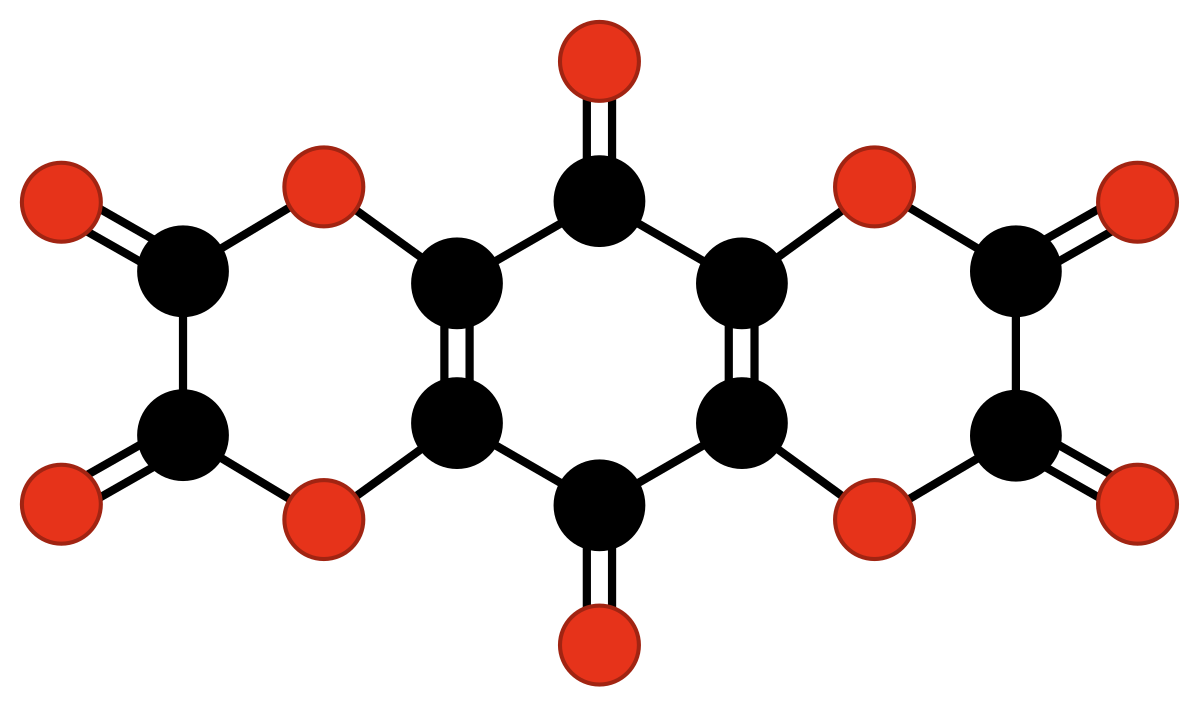
|
| C8O8 ou C6O2(CO3)2 | biscarbonate de tétrahydroxy-1,4-benzoquinone | se décompose vers 45–53 °C. | Nallaiah | 1984 |
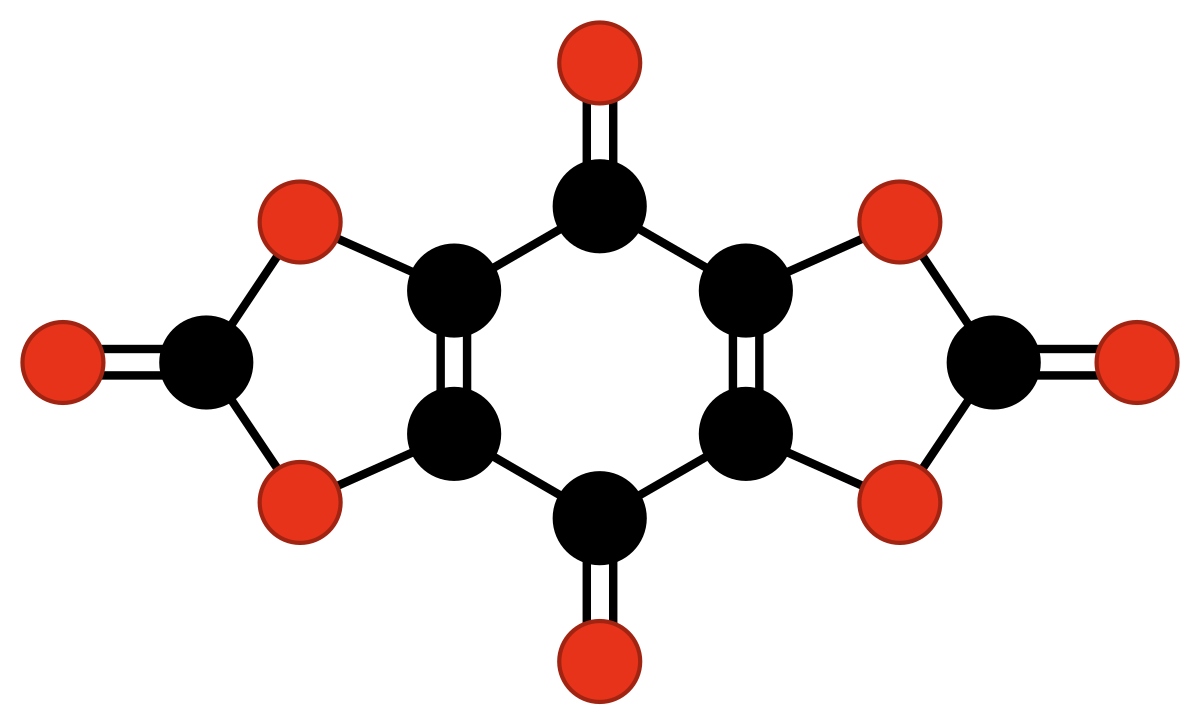
|
| C9O9 ou C6(CO3)3 | triscarbonate d'hexahydroxybenzène | se décompose vers 45–53 °C. | Nallaiah | 1984 |
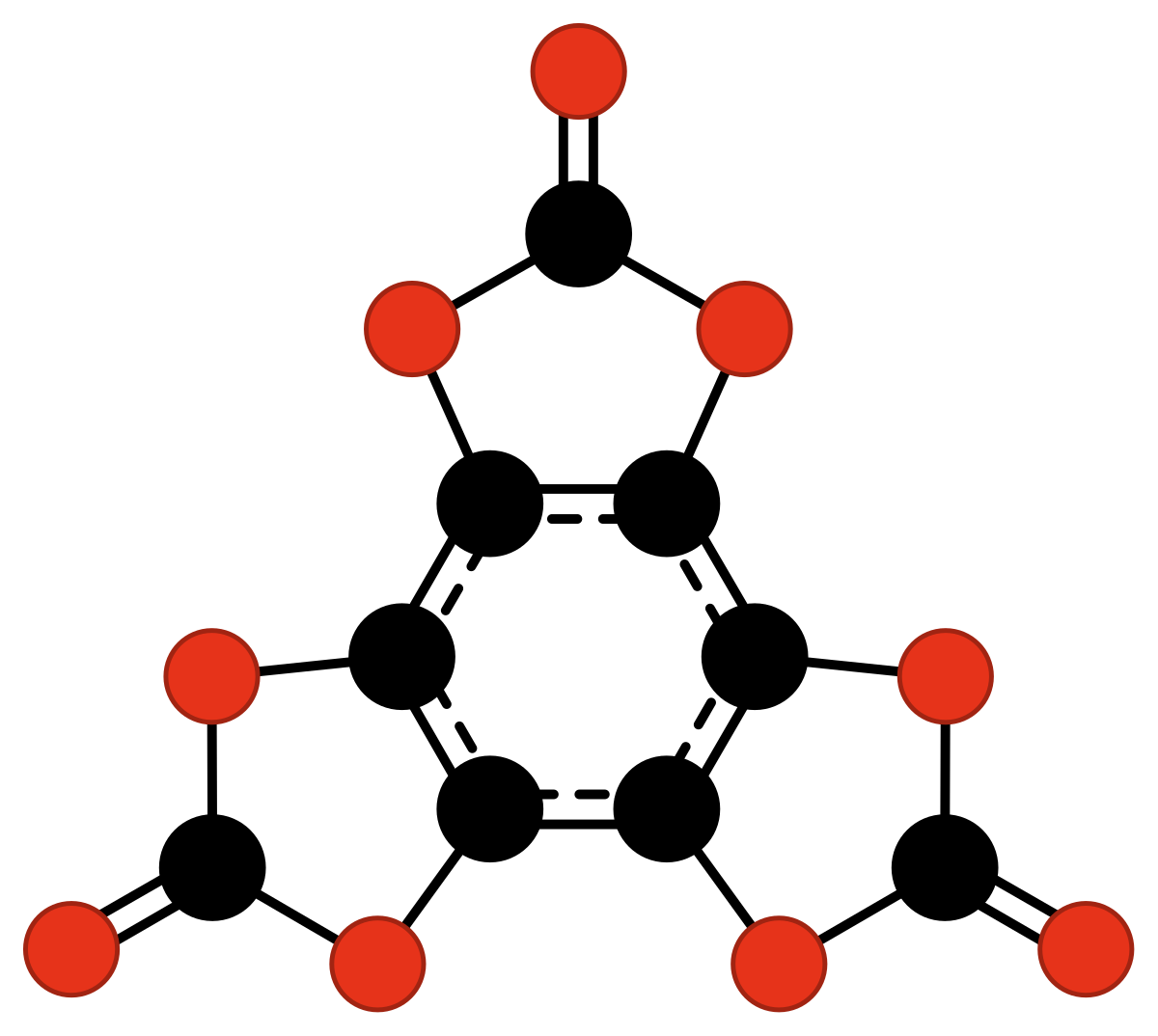
|
| C24O6 | tris(3,4-diéthynyl-3-cyclobutène-1,2-dione) | un trimère cyclique du biradical 3,4-diéthynyl-3-cyclobutène-1,2-dione ▪C≡C-(C4O2)-C≡C▪ | Rubin & al. | 1990 |
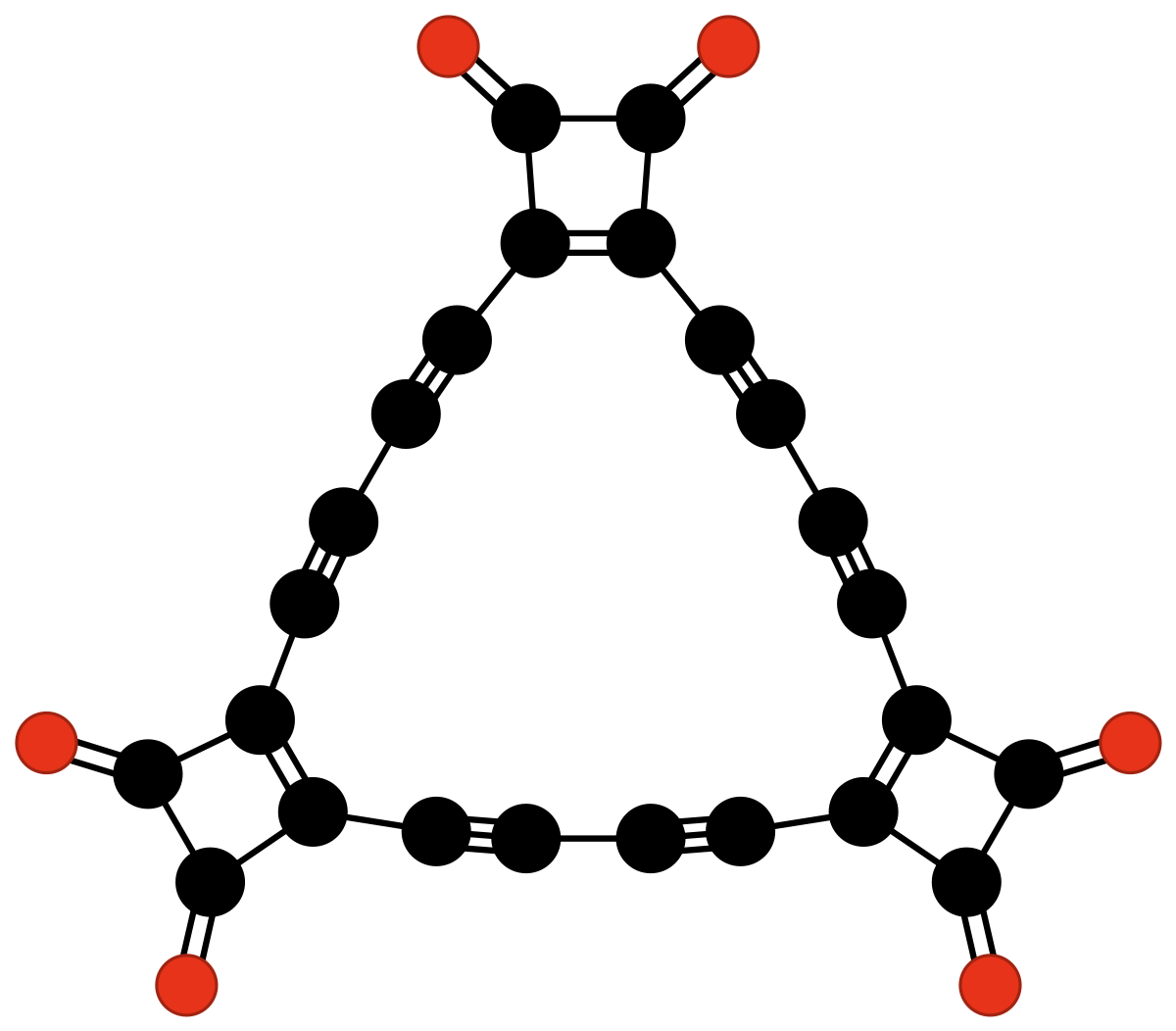
|
| C32O8 | tétrakis(3,4-diéthynyl-3-cyclobutène-1,2-dione) | un tétramère du radical 3,4-diéthynyl-3-cyclobutène-1,2-dione | Rubin & al. | 1990 |
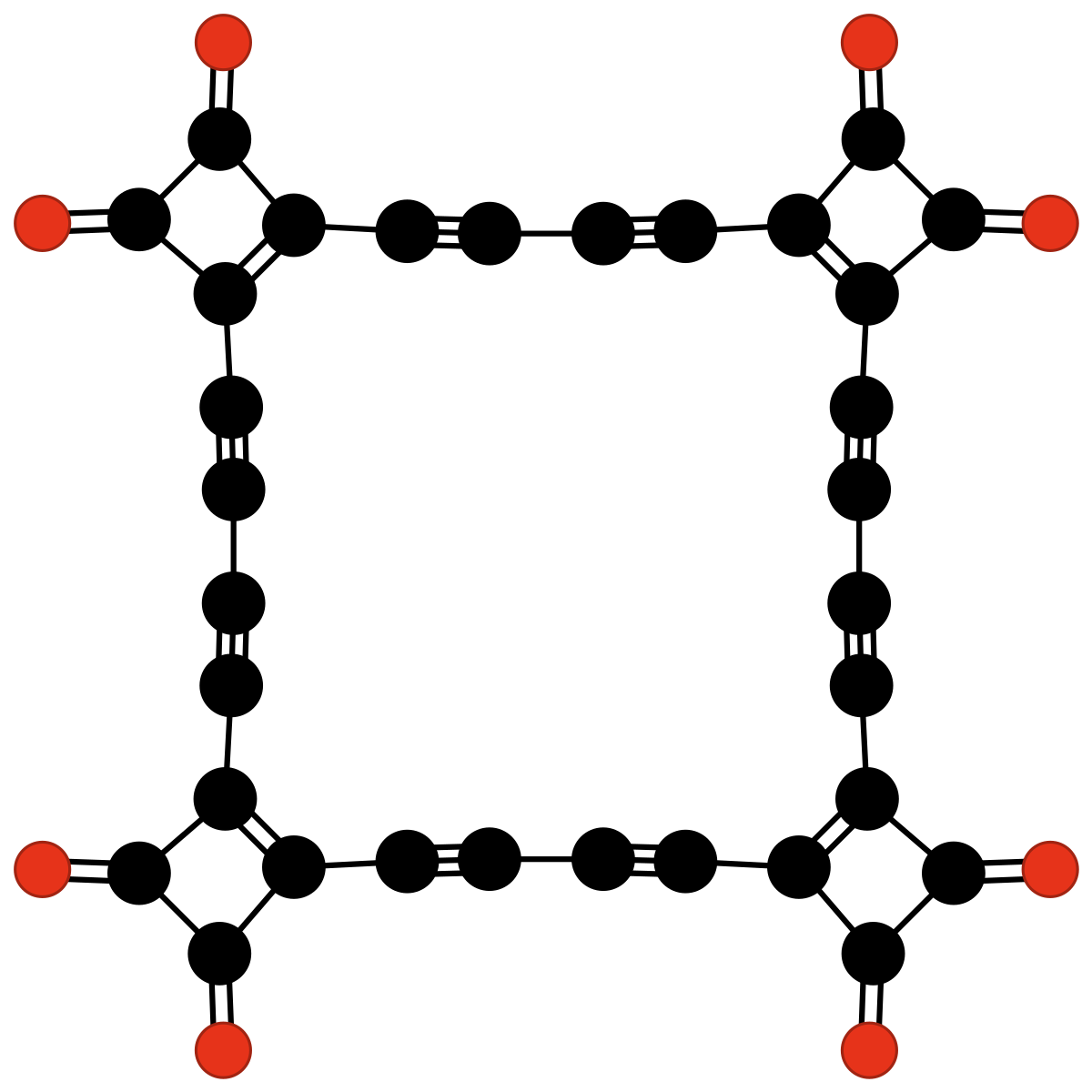
|
| C4O6 | dioxanetétracétone ou dimère de l'anhydride oxalique | stable dans Et2O à -30 °C, mais se décompose à 0 °C. | Strazzolini & al. | 1998 |

|
| C12O6 | hexaoxotricyclobutabenzène | Hamura & al. | 2006 |
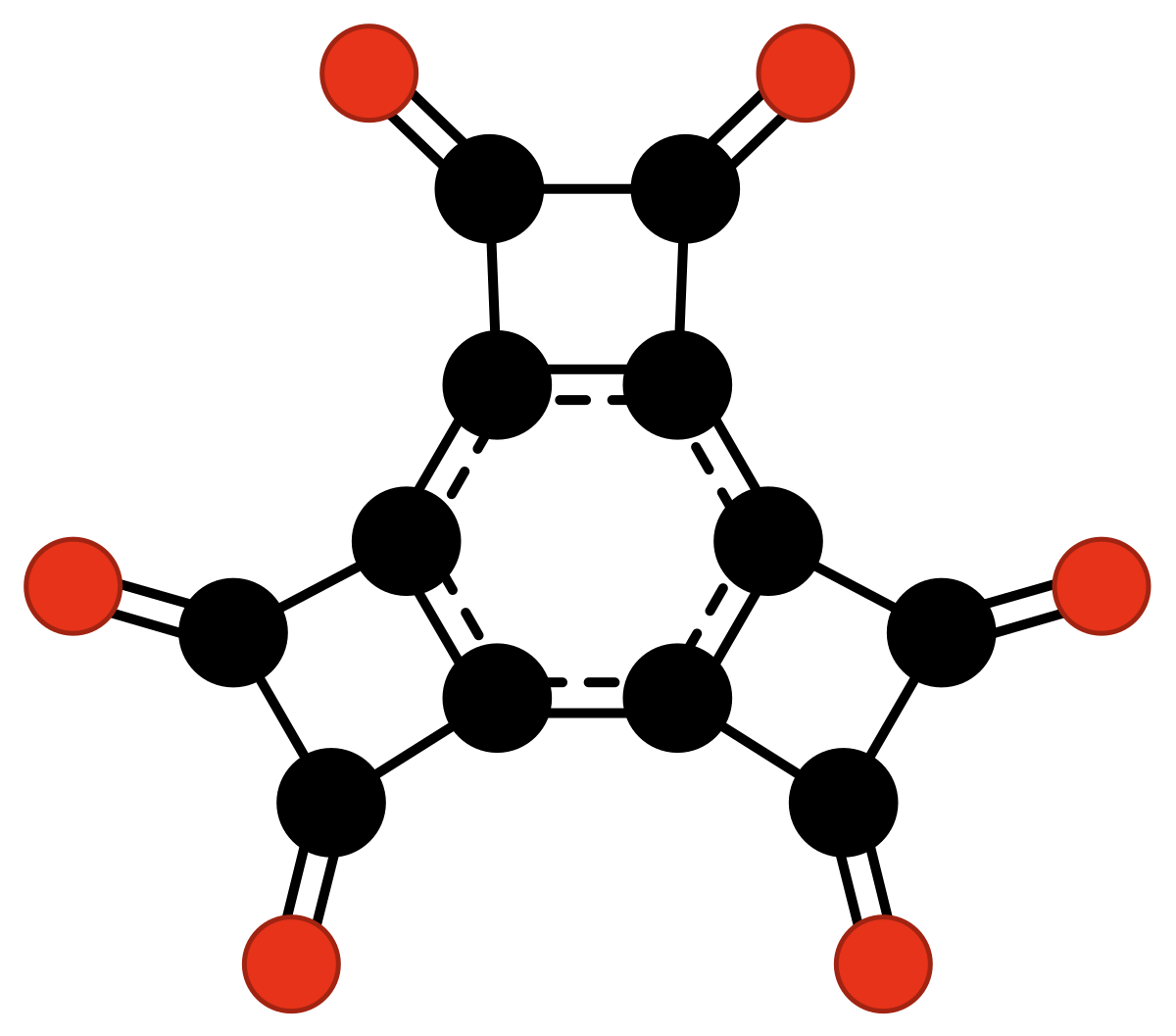
| |
De nombreux composés proches de ces oxydes ont été étudiés théoriquement et certains devraient être stables, comme les esters carbonate et oxalate de la tétrahydroxy-1,2-benzoquinone et des acides rhodizonique, croconique, squarique et deltique.