Suboxyde de carbone - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Suboxyde de carbone | |
|---|---|

| |
| Général | |
| Nom IUPAC | |
| No CAS | |
| PubChem | |
| ChEBI | |
| SMILES | |
| InChI | |
| Apparence | gaz incolore d'odeur forte et âcre |
| Propriétés chimiques | |
| Formule brute | C3O2 |
| Masse molaire | 68,0309 ± 0,003 g·mol-1 |
| Propriétés physiques | |
| T° fusion | −111,3 °C |
| T° ébullition | 6,8 °C |
| Masse volumique | 0,906 ± 0,06 g·cm-3, gaz à 24,85 °C |
| Propriétés optiques | |
| Indice de réfraction |
|
| | |
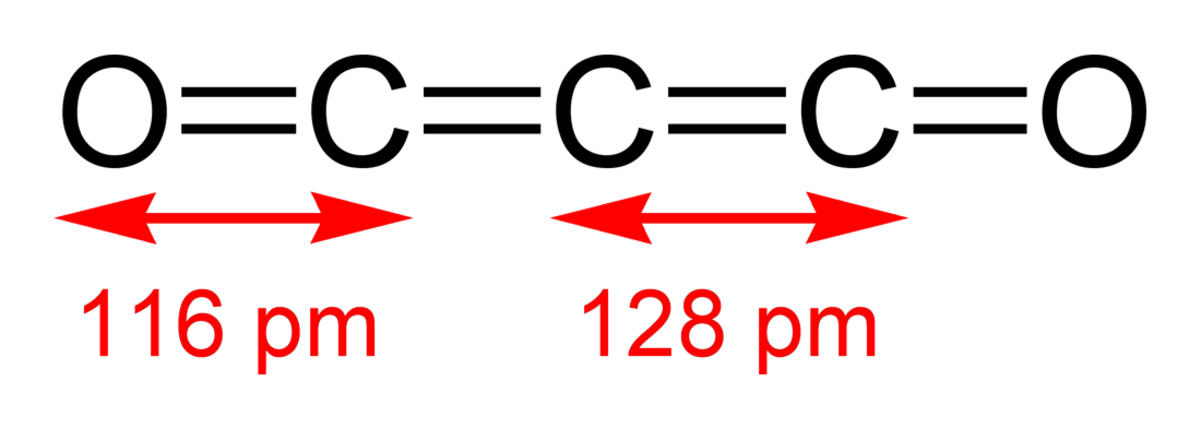
Le suboxyde de carbone ou sous-oxyde de carbone ou dioxyde de tricarbone est un oxyde de carbone de formule C3O2 ou O=C=C=C=O. Ses quatre doubles liaisons consécutives en font un cumulène. C'est aussi un des membres stables de la série d'oxydes de carbone linéaires, O=Cn=O avec n de 1 pour le dioxyde de carbone à 5 pour le dioxyde de pentacarbone, O=C=C=C=C=C=O.
Ce composé a été découvert en 1873 par Sir Benjamin Collins Brodie en soumettant du monoxyde de carbone, CO à un courant électrique. Il affirma que le produit faisait partie d'une série d'oxydes de carbone de formule générale Cx+1Ox soit C, C2O, C3O2, C4O3, C5O4, ..., et avoir identifié les deux derniers. Toutefois, seul C3O2 est connu. En 1891, Marcellin Berthelot a observé que le chauffage de monoxyde de carbone pur,CO à 550 °C crée de petites quantités de dioxyde de carbone, CO2 mais aucune trace de carbone et a supposé qu'un autre oxyde de carbone riche en carbone était donc créé, il le nomma « sous-oxyde ». Il supposa qu'il s'agissait du même produit obtenu par décharge électrique et proposa la formule C2O. Otto Diels a déclaré plus tard que les noms plus organiques de dicarbonylméthane et de dioxallène étaient aussi corrects. Il est plus communément décrit comme un gaz à odeur diabolique.
Préparation et réactions
Le suboxyde de carbone est synthétisé en chauffant un mélange sec de pentoxyde de phosphore, P4O10 et d'acide malonique, HOOC-CH2-COOH ou d'un ester de l'acide malonique. Par conséquent, il peut être considéré comme l'anhydride de l'anhydride malonique, à savoir l'"anhydride second" de l'acide malonique.
Plusieurs autres voies pour la synthèse et les réactions du suboxyde de carbone peuvent être trouvées dans un article de revue de 1930 par L. Reyerson.
En 1969, il a été supposé que la couleur de la surface de Mars était causée par ce composé ce qui a été démenti par les sondes martiennes du programme Viking.