Oxyde de carbone - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Un oxyde de carbone est un composé chimique constitué d'une combinaison d'atomes de carbone et d'oxygène uniquement.
Les plus simples et les plus communs des oxydes de carbone sont le monoxyde de carbone, CO, et le dioxyde de carbone, CO2. Beaucoup d'autres oxydes de carbone stables, métastables ou hypothétiques sont connus mais sont rarement rencontrés comme le suboxyde de carbone C3O2, ou l'anhydride mellitique C12O9, voire très rarement, comme le monoxyde de tricarbone C3O, ou l'élusif tétroxyde de carbone CO4.
|
|
|
|
|
|
|
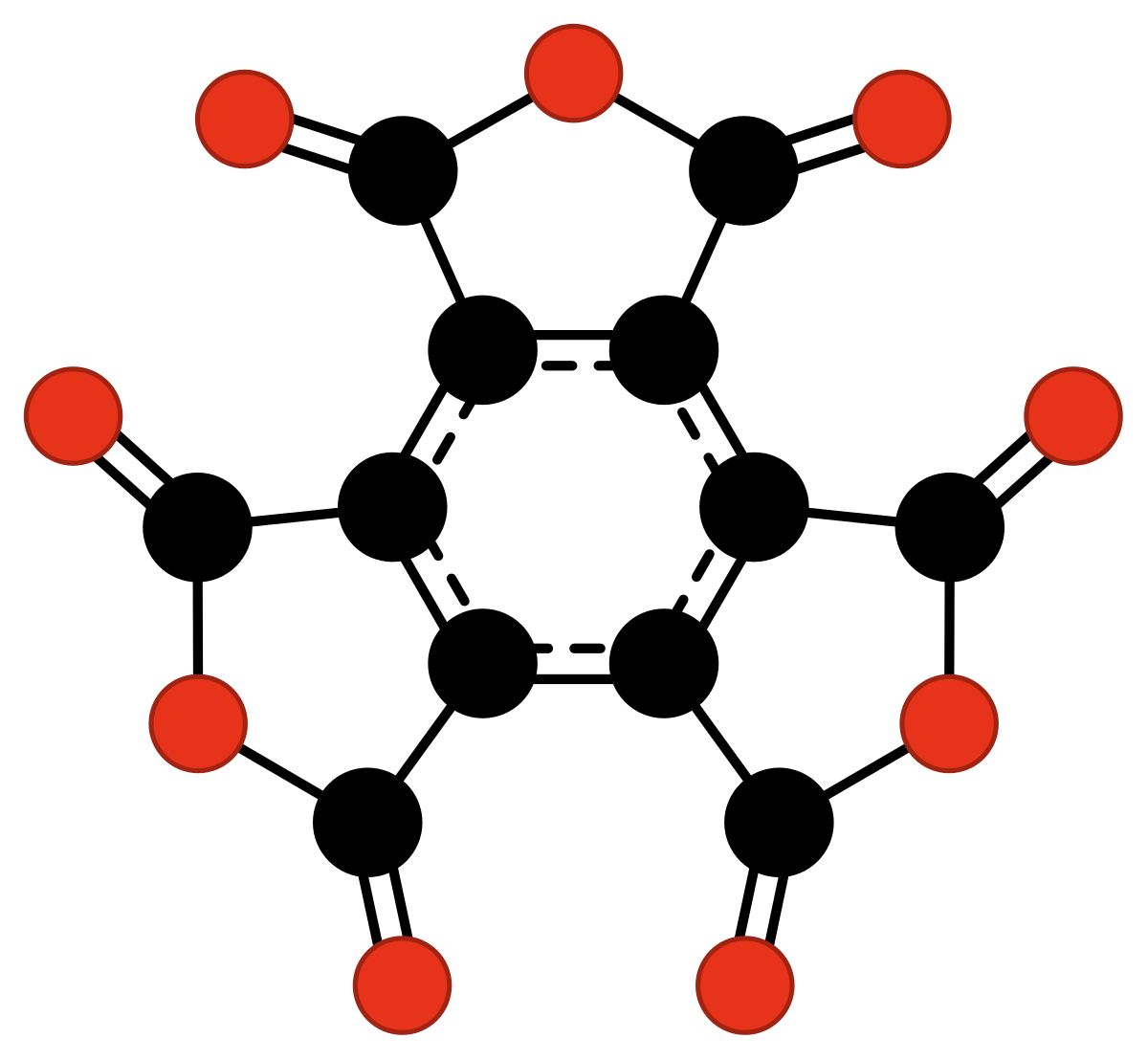
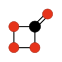
| CO monoxyde de carbone | CO2 dioxyde de carbone | C3O2 suboxyde de carbone | C12O9 anhydride mellitique | C3O monoxyde de tricarbone | CO4 tétroxyde de carbone |
Bien que les manuels de chimie n'affichent souvent que les trois premiers et, rarement, le quatrième, un grand nombre d'autres oxydes de carbone sont aujourd'hui connus, la plupart d'entre eux synthétisés depuis les années 1960. Certains de ces nouveaux oxydes sont stables à température ambiante. Certains, en revanche, sont métastables ou stables uniquement à des températures très basses et se décomposent en oxydes de carbone simples quand ils sont chauffés. Beaucoup sont instables par nature et ne peuvent être observés que momentanément en tant qu'intermédiaires dans des réactions chimiques, ou sont si réactifs qu'ils ne peuvent exister qu'au sein d'une phase gazeuse ou dans des conditions d'isolement en matrice.
L'inventaire des oxydes de carbone semble s'accroître constamment. L'existence de l'oxyde de graphène et d'autres oxydes de carbone polymériques stables avec des structures moléculaires sans borne suggère que beaucoup d'autres restent encore à découvrir.
Vue d'ensemble
Le dioxyde de carbone, CO2, est très fréquent dans la nature, où il est produit notamment par la respiration des êtres vivants ainsi que par la combustion de substances contenant du carbone. C'est une étape essentielle des formes du carbone au cours du cycle du carbone sur Terre et celle sous laquelle il est capté par les plantes. Il a été progressivement reconnu comme un composé chimique, appelé autrefois Sylvestre spiritus (« esprit sauvage ») ou « air fixe » par divers chimistes des XVIIe et XVIIIe siècles, et encore fréquemment gaz carbonique.
Le monoxyde de carbone, CO, peut être aussi produit lors d'une combustion et a été utilisé (quoi qu'étant non reconnu) depuis l'Antiquité pour la fonte du fer de ses minerais. Comme le dioxyde de carbone, il a été décrit et étudié en Europe par divers alchimistes et chimistes depuis le Moyen Âge. Sa composition chimique a été découverte par William Cruikshank en 1800.
Le suboxyde de carbone, C3O2, a été découvert par Benjamin Collins Brodie en 1873 en faisant passer du courant électrique dans du dioxyde de carbone.
Le quatrième oxyde de carbone « classique », l'anhydride mellitique, C12O9, a été apparemment obtenu par Justus von Liebig et Friedrich Wöhler en 1830 pendant leur étude de la mellite (pierre miel), mais n'a été caractérisé qu'en 1913 par Hans Meyer et Karl Steiner.
Brodie a aussi découvert en 1859 un sixième composé appelé oxyde de graphite, composé de carbone et d'oxygène dans des ratios variant de 2:1 à 3:1, mais la nature et la structure moléculaire de cette substance sont restées inconnues jusque dans les années 2000 quand il a été renommé oxyde de graphène et est devenu un sujet de recherche dans les nanotechnologies.
Des exemples notables d'oxydes instables ou métastables qui ne sont détectés que dans des situations extrêmes sont le radical monoxyde de dicarbone :C=C=O, le trioxyde de carbone CO3, le tétroxyde de carbone CO4 et la 1,2-dioxétanedione C2O4. Certains de ces oxydes de carbone réactifs ont été détectés dans les nuages moléculaires du milieu interstellaire par spectroscopie rotationnelle.
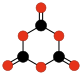
Beaucoup d'oxydes de carbone hypothétiques ont été étudiés par des méthodes théoriques mais n'ont pas encore été détectés. Des exemples en sont l'anhydride oxalique C2O3 ou O=(cyclo-C2O)=O, l'éthènedione C2O2 ou O=C=C=O, les autres polycétones, polymères linéaires ou cycliques de monoxyde de carbone, (-CO-)n et ceux du dioxyde de carbone (-CO2-)n comme le dimère 1,3-dioxétanedione C2O4 et le trimère 1,3,5-trioxanetrione C3O6.
|
|

|

|
|
|
| C2O3 anhydride oxalique | C2O4 1,2-dioxétane- dione | C2O4 1,3-dioxétane- dione | C3O6 1,3,5-trioxane- trione | C2O2 éthènedione |























































