Triclosan - Définition
La liste des auteurs de cet article est disponible ici.
| Triclosan | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | poudre blanche | ||
| Propriétés chimiques | |||
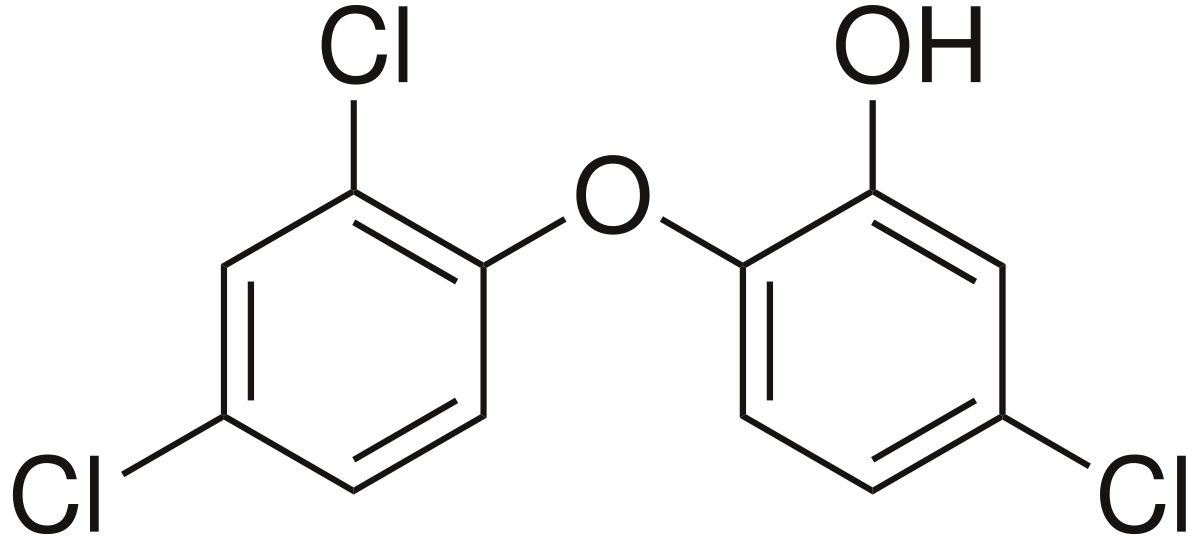
| Formule brute | C12H7Cl3O2 | ||
| Masse molaire | 289,542 ± 0,017 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | 54 à 57,3 °C | ||
| T° ébullition | >280 °C décomposition | ||
| Solubilité | 10 mg·l-1 eau à 20 °C | ||
| Point d’éclair | 223 °C | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 36/38, 50/53, | |||
| Phrases S : 26, 39, 46, 60, 61, | |||
| | |||


Attention | |||
| Écotoxicologie | |||
| DL | 3 700 mg·kg-1 rat oral 29 mg·kg-1 rat i.v. 3 900 mg·kg-1 rat s.c. 89 mg·kg-1 rat i.p. | ||
| | |||
Le triclosan est un agent antifongique et antibactérien à large spectre. Il est aussi appelé 5-chloro-2-(2,4-dichlorophénoxy)phénol.
On le trouve dans des savons, des déodorants, des dentifrices et beaucoup de produits de consommation courante sont imprégnés de triclosan : ustensiles de cuisine, jouets, literie, sacs poubelle... Il diminue la contamination bactérienne sur les mains et les produits traités.
Le triclosan a été suspecté de causer le développement de bactéries plus résistantes. Mais aucune étude n'a pu prouver cet effet à ce jour.
Des études ont montré que le triclosan peut se combiner avec le chlore pour former du chloroforme gazeux. Les conditions nécessaires à cette réaction chimique exigent un excès significatif de chlore ainsi qu’une forte concentration de triclosan.
Le triclosan fait partie des perturbateurs endocriniens. Ses effets ont notamment été observés chez les amphibiens (Rana catesbeiana, Xenopus laevis). Il a montré une toxicité chronique et aiguë chez les espèces aquatiques. En outre, le triclosan est bioaccumulatif.



















































