Quantité de matière - Définition
La quantité de matière est une grandeur de comptage d'entités chimiques ou physiques élémentaires. L'unité qui lui correspond est la mole.
La quantité de matière ne doit pas être confondue avec la masse qui comprend aussi de l'énergie et qui s'exprime en kilogrammes.
Formules concernant les quantités de matières
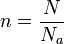
n quantité de matière
N nombre d'atomes
Na constante d'Avogadro (6,023e23 mol-1)
En 2003, une nouvelle valeur à été déterminée par une équipe de chercheurs :
Na ~= 6,0221353e23 mol-1
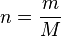
n quantité de matière
m masse de l'échantillon
M masse molaire de l'espèce (masse d'une mole de cette espèce)
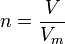
n quantité de matière
V volume de l'échantillon
Vm volume molaire de l'espèce (volume d'une mole de cette espèce) Le volume molaire est employé pour les gaz. Il dépend des conditions de température et de pression. A 25° C et à pression atmosphérique le volume molaire des gaz est de 24 L par mole. Ce volume ne dépend pas de la nature du gaz.
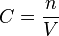
C concentration molaire (quantité de matière par unité de volume)
n quantité de matière
V volume
.

















































