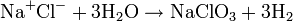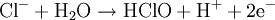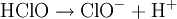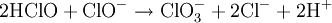Chlorate de sodium - Définition
La liste des auteurs de cet article est disponible ici.
Le chlorate de soude en France
Le chlorate de soude était, il y a de cela quelques années, vendu en grande surface à un taux de >95% de pureté. Toutes personnes pouvaient en acheter, aujourd'hui le chlorate qui se vend au grand public à un taux de 60% car la législation française a été modifiée de par la fréquence des accidents dus au chlorate de soude, et à leur utilisation en tant qu'oxydant dans des réactions explosives. De plus en plus, l'on rencontre le chlorate de soude (désherbant) n'ayant qu'une concentration de 23,7% de NaClO3. Le chlorate à 60% est moins réactif lorsqu'il est mélangé à d'autres substances, ce qui permet d'éviter des accidents mais ce qui diminue fortement l'efficacité du désherbant, alors que le désherbant à 23,7% de NaClO3, n'est pratiquement plus du tout réactif.
Du fait de ces accidents, le Chlorate de soude a été retiré de la vente le 31 decembre 2009.
Articles connexes
- Sodium
- Chlorate
- Pyrotechnie
- Dioxyde de chlore
- Electrolyse de l'eau
Équation des réactions
Réaction globale
La réaction globale est en fait une série de petites réactions, soit :