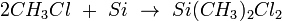Chlorométhane - Définition
La liste des auteurs de cet article est disponible ici.
Production et synthèse
Ce gaz est produit par chloration du méthane avec du chlore gazeux à 400 à 500 °C. Le mécanisme de chloration est une réaction radicalaire en chaîne via des radicaux issus de la dissociation du chlore. Cette dissociation peut être obtenue par voie thermique, photochimique ou par des catalyseurs. La voie thermique est préférée et elle conduit à une série de substitutions successives:
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CHCl3 + HCl
- CHCl3 + Cl2 → CCl4 + HCl
Le résultat de cette série de réaction est un mélange de chlorométhane, dichlorométhane, chloroforme et tétrachlorure de carbone. Ces composés sont ensuite séparés par distillation. Un excès de méthane est utilisé dans le réacteur et un recyclage est employé en présence d'un gaz inerte afin d'éviter de travailler dans un domaine où le mélange méthane-chlore est explosif.
Une autre voie de synthèse est l'hydrochloration du méthanol par du chlorure d'hydrogène. Cette réaction est actuellement privilégiée, car elle consomme du chlorure d'hydrogène, au lieu d'en produire comme dans le cas de la chloration, qui est un sous-produit difficile à écouler. De plus la synthèse conduit à la seule production du chlorométhane et évite la production des composés multichlorés.
Utilisation
Le chlorométhane est utilisé pour la préparation du diméthyldichlorosilane via la synthèse de Müller-Rochow:
C'est une voie de synthèse importante pour la fabrication des silicones.
Il est aussi utilisé comme réactif pour la réaction de Wurtz-Fittig ou les réactions de Friedel-Crafts utilsée pour la production d'alkylbenzènes. C'est un réactif important pour la méthylation notamment des amines pour la formation de méthylamines quaternaires ou des goupes hydroxyles pour former de éthers.