Chlorométhane - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
Introduction
| Chlorométhane | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | chlorure de méthyle Fréon 40 R40 | ||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| ChEBI | |||
| SMILES | |||
| InChI | |||
| Apparence | gaz incolore à odeur douceâtre | ||
| Propriétés chimiques | |||
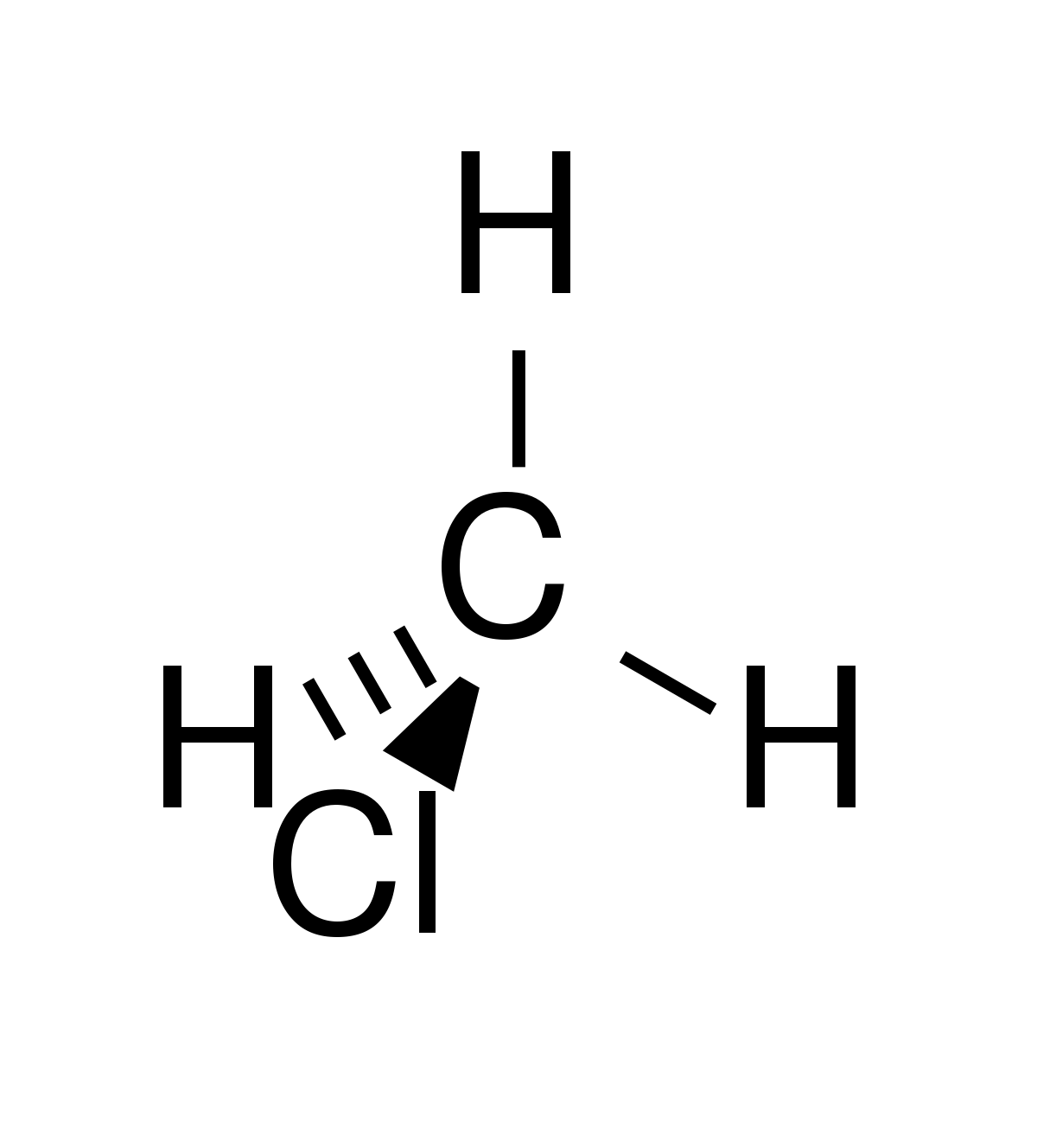
| Formule brute | CH3Cl | ||
| Masse molaire | 50,488 ± 0,003 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | -97,6 °C | ||
| T° ébullition | -24,2 °C | ||
| Solubilité | 5 g·l-1 (eau,25 °C) | ||
| Masse volumique | 2,3065 g·l-1 (0 °C,1 013 mbar) | ||
| T° d’auto-inflammation | 632 °C | ||
| Limites d’explosivité dans l’air | 7,6 - 19 Vol.% | ||
| Pression de vapeur saturante | 4,896 bar à 20 °C 6,6 bar à 30 °C 10,9 bar à 50 °C | ||
| Point critique | 143 °C, 66,7 bar, 0,353 kg·l-1 | ||
| Point triple | -97,71 °C, 0,00876 bar | ||
| Thermochimie | |||
| S0 | 234,36 J·K-1·mol-1 | ||
| S0 | 140,08 J·K-1·mol-1 | ||
| ΔH0 | -83,68 kJ·mol-1 | ||
| ΔH0 | -102,4 kJ·mol-1 | ||
| ΔH° | 6,431 kJ·mol-1 à 175,44 K | ||
| ΔH° | 20,5 kJ·mol-1 | ||
| Cp | 81,2 J·K-1·mol-1 à 298 K | ||
| PCI | -764,0 kJ·mol-1 (gaz) | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 11,22 ± 0,01 eV (gaz) | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 12, 40, 48/20, | |||
| Phrases S : 2, 9, 16, 33, | |||
| | |||
| |||
| | |||
|
4 2 0 | |||
| | |||


Danger | |||
| | |||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme | |||
| Écotoxicologie | |||
| DL | 1,8 g/kg (rat, oral) | ||
| LogP | 0,91 | ||
| Seuil de l’odorat | bas : 10 ppm | ||
| | |||
Le chlorométhane, connu aussi sous le nom de chlorure de méthyle, de Fréon 40, ou R40, est un fluide frigorigène qui est également utilisé comme réactif pour de nombreuses synthèses.
Propriétés physico-chimiques
Le chlorométhane est hydrolysé par l'eau à haute température pour former du méthanol et du chlorure d'hydrogène. Cette réaction est catalysée par des composés alcalins. A plus basse température, le chlorométhane forme un hydrate avec l'eau, ce qui pose problème dans les systèmes de réfrigération.




















































