Diméthylsulfoxyde - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Diméthylsulfoxyde | |
|---|---|
| |
| Général | |
| Nom IUPAC | |
| Synonymes | sulfinylbisméthane Méthylsulfoxyde |
| No CAS | |
| No EINECS | |
| Code ATC | G04 M02 |
| DrugBank | |
| PubChem | |
| FEMA | |
| SMILES | |
| InChI | |
| Apparence | liquide hygroscopique, incolore. |
| Propriétés chimiques | |
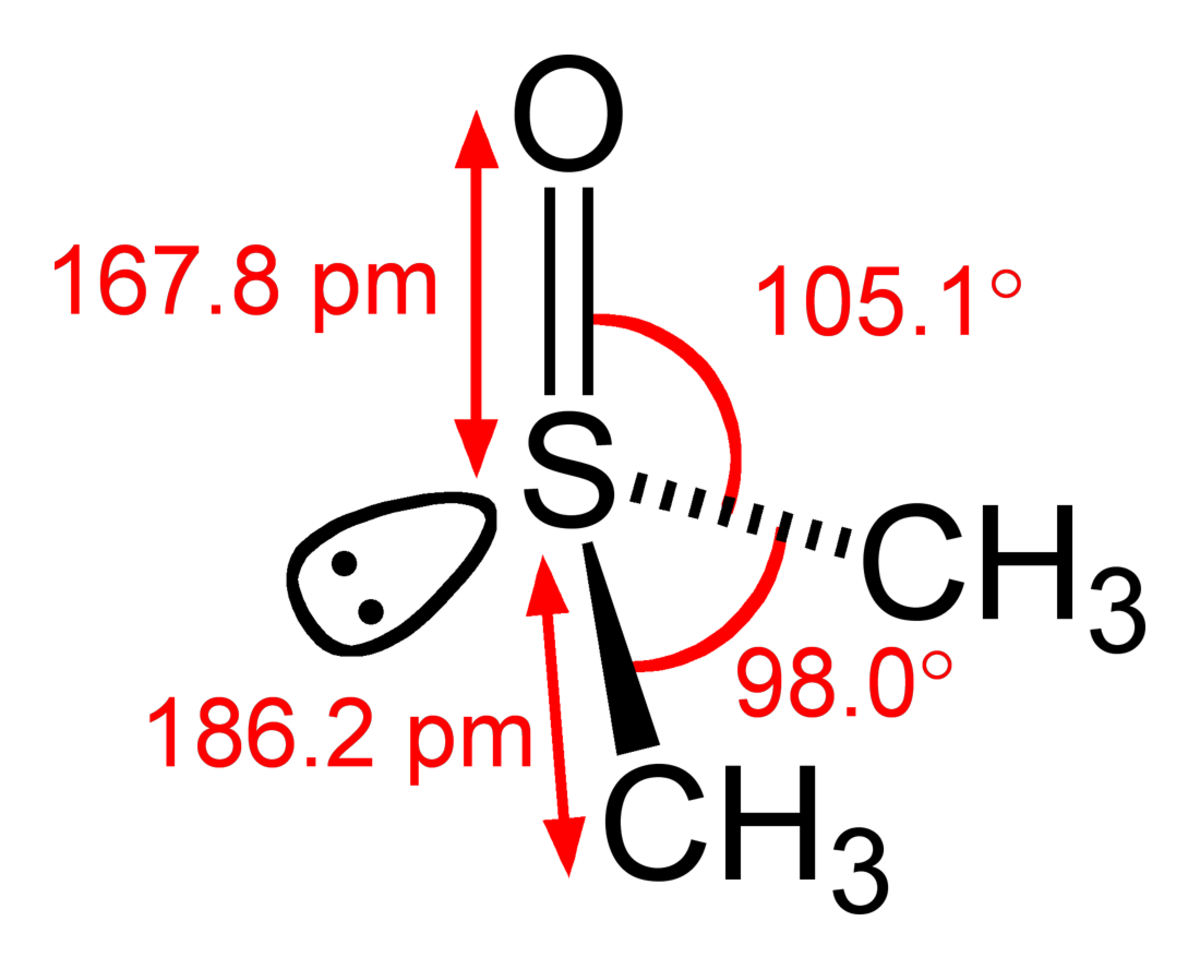
| Formule brute | C2H6OS |
| Masse molaire | 78,133 ± 0,007 g·mol-1 |
| Moment dipolaire | 4,06 D |
| Diamètre moléculaire | 0,513 nm |
| Propriétés physiques | |
| T° fusion | 18,5 °C |
| T° ébullition | 190,85 °C |
| Solubilité | 1 000 g·l-1 à 20 °C |
| Masse volumique | (eau = 1) : 1.1 |
| T° d’auto-inflammation | 270 °C |
| Point d’éclair | 88 °C |
| Limites d’explosivité dans l’air | 1,8- Vol.% |
| Pression de vapeur saturante | à 20 °C : 59,4 Pa |
| Viscosité dynamique | 1,996 cP à 20 °C (293 K) |
| Thermochimie | |
| S0 | 188,78 J·mol-1 |
| ΔH0 | -150,5 kJ·mol-1 à 25 °C |
| ΔH0 | -203,4 kJ·mol-1 à 25 °C |
| ΔH° | 14,368 kJ·mol-1 à 18,52 °C |
| ΔH° | 52,9 kJ·mol-1 à 25 °C |
| Cp | 149,39 J·mol-1·K-1 à 25 °C |
| PCI | -2 037,3 kJ·mol-1 |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 9,10 ± 0,03 eV (gaz) |
| Propriétés optiques | |
| Indice de réfraction |
|
| Précautions | |
| | |
|
2 2 0 | |
| | |

| |
| | |
Le diméthylsulfoxyde noté aussi DMSO est un solvant organique de formule brute C2H6OS. C'est un composé organo-sulfuré.
Utilisation
C'est un liquide incolore qui est utilisé en chimie et en pharmaceutique pour sa capacité à solubiliser de nombreux solvants organiques, mais également des sels du fait de sa forte polarité. Dilué de 5 à 20%, il est utilisé comme agent cryoprotecteur lors de la congélation de cellules, ou de gamètes. Il présente également des propriétés anesthésiques et anti-bactériennes.
Production et synthèse
La production industrielle de DMSO consiste en l'oxydation catalytique du sulfure de diméthyle en présence d'oxygène ou de dioxyde d'azote. Sans catalyseur la réaction est possible à une pression de 7,2 MPa et à 105 °C avec un rendement supérieur à 90%.
Propriétés physico-chimiques
Le diméthylsulfoxyde est aussi un produit entraînant une plus grande absorption des toxines par les pores de la peau lorsqu'il est mis en contact avec celle-ci. C'est un solvant aprotique polaire (de plus on observe un effet mésomère sur la double liaison O).



















































