Triphénylphosphine - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Triphénylphosphine | ||
|---|---|---|
| ||
| Général | ||
| Nom IUPAC | ||
| No CAS | ||
| No EINECS | ||
| SMILES | ||
| InChI | ||
| Apparence | cristaux blancs sans odeur. | |
| Propriétés chimiques | ||
| Formule brute | C18H15P | |
| Masse molaire | 262,2855 ± 0,0155 g·mol-1 | |
| Propriétés physiques | ||
| T° fusion | 80 °C | |
| T° ébullition | 377 °C | |
| Solubilité | dans l'eau : nulle | |
| Masse volumique | 1,1 g·cm-3 | |
| Point d’éclair | 180 °C (coupelle ouverte) | |
| Thermochimie | ||
| Cp | ||
| Précautions | ||
| | ||
| ||
| Phrases R : 22, 43, 53, | ||
| Phrases S : 24, 37, 61, | ||
| | ||
|
1 0 0 | ||
| Écotoxicologie | ||
| DL | 700 mg·kg-1 (rats, oral) | |
| Valeur d'exposition | 5 mg·m-3 | |
| | ||
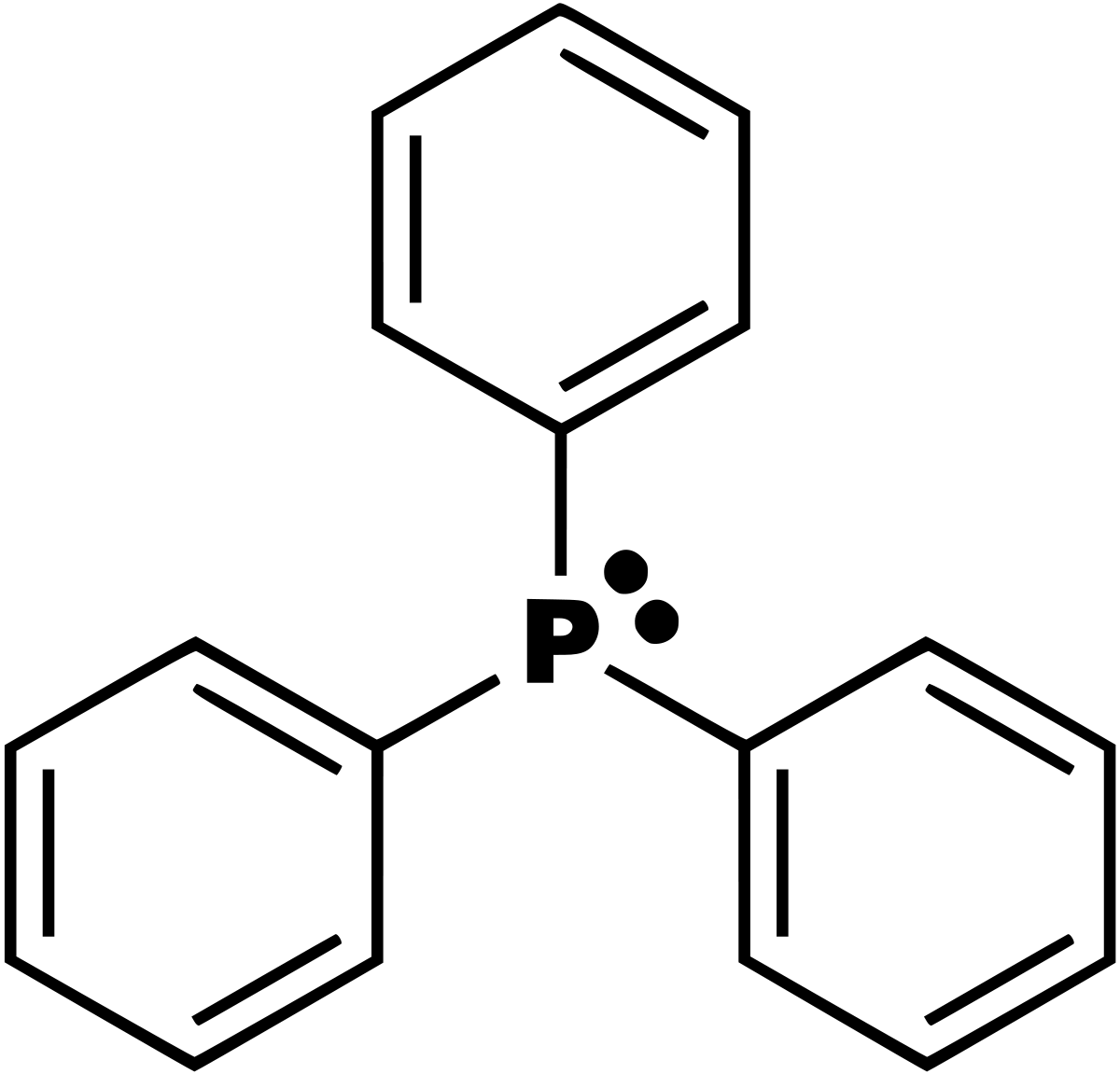
La triphénylphosphine (ou triphénylphosphane), est un composé organophosphoré de formule P(C6H5)3 - parfois abrégé en PPh3 ou Ph3P. Il est largement utilisé dans la synthèse de composés organiques et d'organométalliques. C'est un composé relativement stable qui existe sous la forme d'un solide cristallin à température ambiante et qui se dissout dans les solvants non-polaires comme le benzène.
Préparation
Même si elle n'est pas chère, la triphénylphosphine peut être préparée en laboratoire par traitement du trichlorure de phosphore avec le bromure de phénylmagnésium ou le phényllithium. La synthèse industrielle met en jeu la réaction de Friedel-Crafts entre le trichlorure de phosphore et le benzène. La triphénylphosphine peut être recristallisée soit dans l'éthanol chaud soit dans l'isopropanol chaud. Cette purification est parfois conseillée pour enlever l'oxyde de triphénylphosphine, de formule OP(C6H5)3, qui s'est formé par oxydation lente par l'air.
Réactions avec les composés inorganiques et les organométalliques
La triphénylphosphine est souvent utilisée comme ligand d'un cation métallique pour former un complexe de coordination. Elle se lie à la plupart des métaux de transition, en particulier aux métaux du milieu et de la fin du bloc d comme le palladium, le platine, le ruthénium, le nickel et l'osmium. Exemple : le Tetrakis(triphenylphosphine) de palladium(0). Les triphénylamines correspondantes ont une faible affinité pour les métaux de transition. Cette différence s'explique par la plus petite taille de l'atome d'azote, ce qui entraîne une plus grande gène stérique limitant l'approche du ligand vers le centre métallique.
Les composés de type metal-P(C6H5)3 sont caractérisés par spectroscopie RMN du 31P.
La triphénylphosphine capte le soufre à partir de nombreux composés sulfurés, y compris du soufre élémentaire. Le produit phosphoré est SP(C6H5)3. Cette réaction peut être utilisée pour analyser les taux de soufre.
Principales réactions organiques
P(C6H5)3 est largement utilisé en synthèse organique. La réaction du P(C6H5)3 sur les halogénoalcanes conduit à des sels phosphoriques appelés aussi sels de phosphonium.
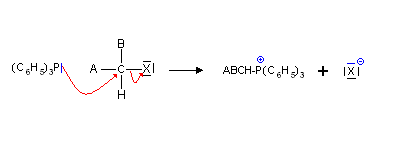
Ces sels réagissent avec des bases fortes (type organométalliques par exemple les organolithiens, ions amidures -NH2- ou hydrure H-, des bases moins fortes pouvant être utilisées dans certain cas) pour former des ylures de phosphore, appelés aussi phosphoranes.
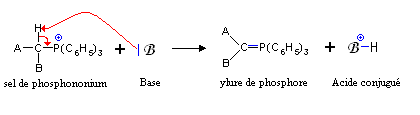
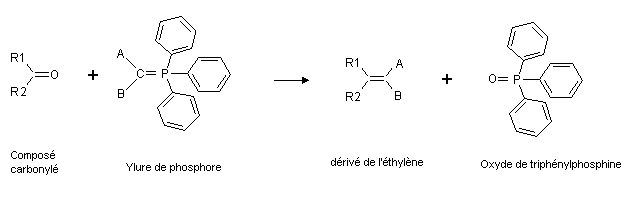
Ces molécules sont utilisées en particulier dans la Réaction de Wittig, où, créees in situ, elles réagissent avec des composés carbonylés, aldéhydes ou cétones, pour former des dérivés éthylèniques, voire des alcènes.
La réaction de P(C6H5)3 sur les chlorines donne Cl2P(C6H5)3, crée in situ pour transformer les alcools en dérivés chlorés , formant par la même occasion HCl et un oxyde de tryphénylphosphine O=P(C6H5)3.



















































