Tyrosine hydroxylase - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
La tyrosine hydroxylase est l'enzyme qui catalyse la transformation de la tyrosine en L-Dopa (DihydrOxyPhénylAlanine).
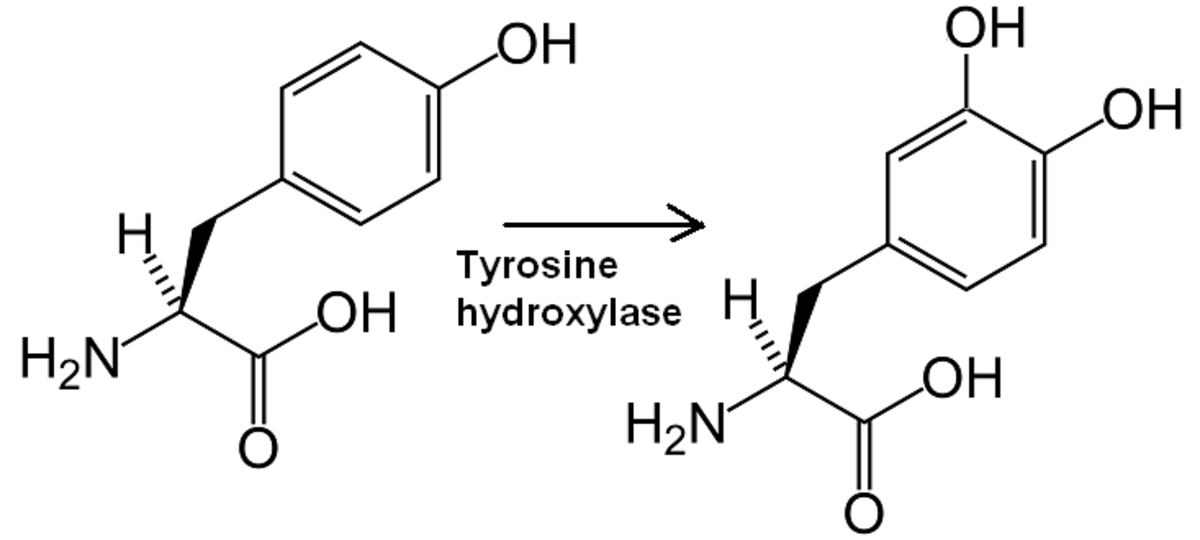
Structure et caractéristiques de la tyrosine hydroxylase
La tyrosine hydroxylase (TH), aussi appelée tyrosine-3-monooxygénase, appartient à la famille des hydroxylases des acides aminés aromatiques. Elles sont dépendantes de la tétrahydrobioptérine et du fer mais leur structure n’est pas hème. En effet, la TH nécessite un cofacteur naturel donneur d’hydrogène, la tétrahydrobioptérine (HBPt), synthétisée à partir de la guanosine 5’ triphosphate dans les cellules possédant l’enzyme tyrosine hydroxylase. La tyrosine hydroxylase possède dans sa structure un site actif, du fer (II) qui est relié à deux histidines ainsi qu’à plusieurs ligands qui possèdent de l’oxygène, comme de l’eau; et ce selon une structure hexagonale. La tyrosine hydroxylase a une masse atomique de 240 kilodaltons et est formée de quatre sous-unités identiques d’environ 60 kDa. D’après la séquence de nucléotides, il a été établi que le gène de la tyrosine hydroxylase compte environ 8,5 kilobases et est formé de 14 exons séparés par 12 introns. Cette enzyme est présente sous quatre formes chez l’humain tandis qu’elle existe uniquement sous une forme chez les animaux. L’ARN messager de ces quatre isoenzymes sont majoritairement identiques sauf près de l’extrémité N-terminale. Ces différences sont dues à des insertions et des délétions spécifiques. Cette enzyme est cytoplasmique et on la retrouve à des endroits précis dans le cerveau, soient dans la substance noire, dans le locus coeruleus et dans la médullaire surrénale.
La tyrosine hydroxylase est formée de deux domaines, soient un catalyseur et un régulateur. Le domaine catalyseur est situé près de l’extrémité C-terminale et est caractérisé par la présence d’acides aminés conservés à travers les espèces. En effet, ce domaine contient sept cystéines chez l’humain et six de ces sept cystéines sont présentes chez les animaux. La cystéine permet le maintien de la conformation de la tyrosine hydroxylase car elle forme des ponts disulfures et interagit avec le fer. Le domaine régulateur est plutôt situé à l’extrémité N-terminale et possède un effet inhibiteur sur l’activité de l’enzyme. Il a aussi été démontré que la phosphorylation et la déphosphorylation de la tyrosine hydroxylase régulent l’activité de cette enzyme. Cette régulation affecte plus particulièrement l’activité dopaminergique nigro-striée. La phosphorylation est effectuée par différentes protéines kinases et on dénombre pour le moment cinq sites de phosphorylation situés à l’extrémité N-terminale : sérine-8, sérine-19, sérine-31, sérine-40 et sérine-153. La phosphorylation de chacun de ces sites est effectuée par différentes enzymes et selon différents mécanismes. Puisque la phosphorylation joue un rôle important dans la régulation de l’activité de la tyrosine hydroxylase, il pourrait être possible d’augmenter la synthèse de dopamine en augmentant cette phosphorylation. Ceci pourrait s’effectuer en activant une ou plusieurs kinases tout en inhibant une ou plusieurs phosphatases, des enzymes qui déphosphorylent la tyrosine hydroxylase. Ceci a d’ailleurs été observé à l’aide de l’acide okadaic, un inhibiteur de phosphatases, ce qui a permis d’observer une augmentation de l’activité de la TH dans des cultures cellulaires. Cet acide est par contre inutilisable chez l’humain car il est cancérigène.

















































