Acide méthanoïque - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
Introduction
| Acide méthanoïque | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | Acide formique Acide hydroxycarboxylique | ||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| No E | E236 | ||
| FEMA | |||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore, fumant, d'odeur âcre | ||
| Propriétés chimiques | |||
| Formule brute | CH2O2 | ||
| Masse molaire | 46,0254 ± 0,0015 g·mol-1 | ||
| pKa | 3,751 (25 °C) | ||
| Moment dipolaire | 1,425 ± 0,002 D | ||
| Diamètre moléculaire | 0,381 nm | ||
| Propriétés physiques | |||
| T° fusion | 8,3 °C | ||
| T° ébullition | 101 °C | ||
| Solubilité | 1 000 g·l-1 (eau, 25 °C), miscible avec l'éthanol, l'acétone et l'éther | ||
| Masse volumique | 1,22 à 25 °C | ||
| T° d’auto-inflammation | 520 °C | ||
| Point d’éclair | 69 °C | ||
| Limites d’explosivité dans l’air | 14–34 %vol | ||
| Pression de vapeur saturante | 42,6 mmHg (25 °C) | ||
| Viscosité dynamique | 1,57.10-3 Pa.s à 26 °C | ||
| Point critique | 306,85 °C | ||
| Point triple | 281,45 K (8,3 °C) 23,6 mbar | ||
| Thermochimie | |||
| S0 | 248,7 J⋅mol-1⋅K-1 | ||
| S0 | 131,8 J⋅mol-1⋅K-1 | ||
| ΔH0 | -378,6 kJ⋅mol-1 | ||
| ΔH0 | -425,1 kJ⋅mol-1 | ||
| Cp | 45,7 J⋅mol-1⋅K-1 (vapeur) 99,0 J⋅mol-1⋅K-1 (liquide) | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 11,33 ± 0,01 eV (gaz) | ||
| Propriétés optiques | |||
| Indice de réfraction |
| ||
| Précautions | |||
| | |||
| |||
| Phrases R : 35, | |||
| Phrases S : (1/2), 23, 26, 45, | |||
| | |||
| |||
| | |||
|
2 3 0 | |||
| | |||


| |||
| | |||

Danger | |||
| Inhalation | Les vapeurs concentrées sont corrosives | ||
| Ingestion | Toxique, peut provoquer des réactions allergiques. Agent mutagène suspecté | ||
| Écotoxicologie | |||
| DL | 700 mg·kg-1 (souris, oral) 145 mg·kg-1 (souris, i.v.) 940 mg·kg-1 (souris, i.p.) | ||
| LogP | -0,54 | ||
| Seuil de l’odorat | bas : 1,6 ppm haut : 340 ppm | ||
| | |||
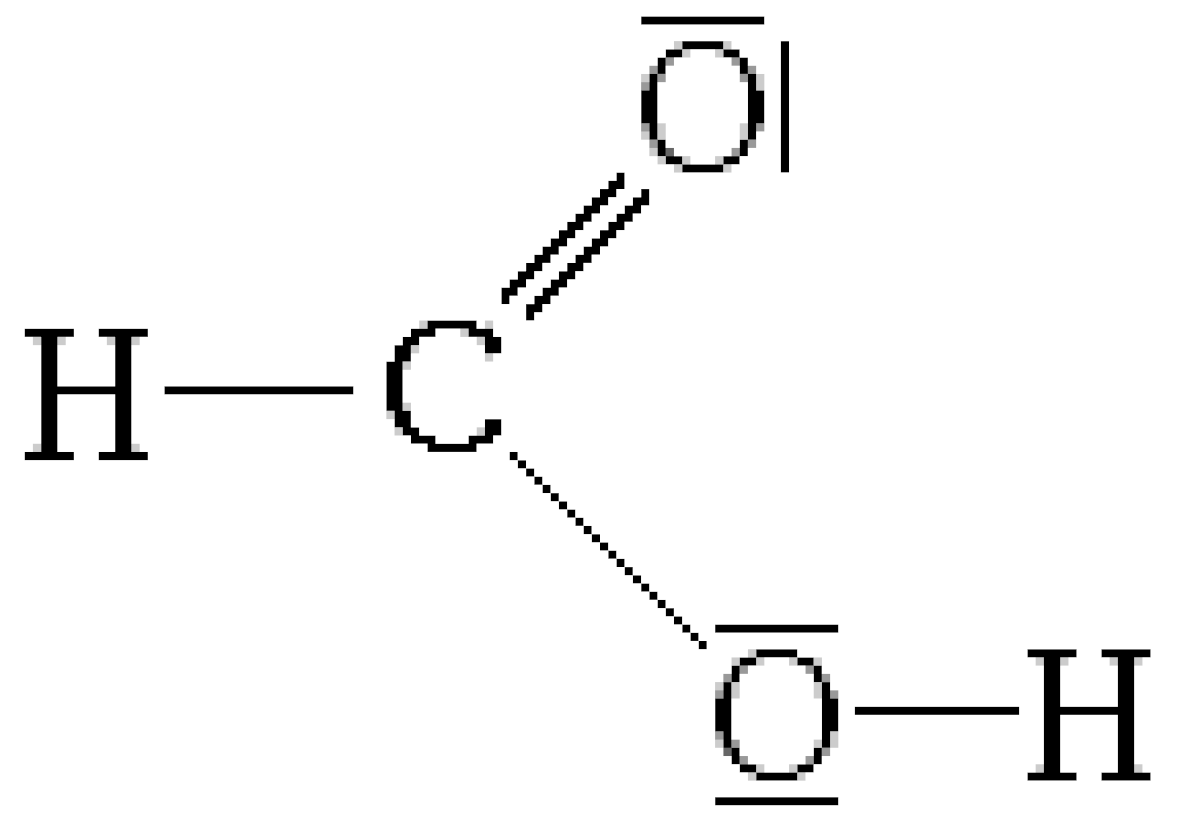
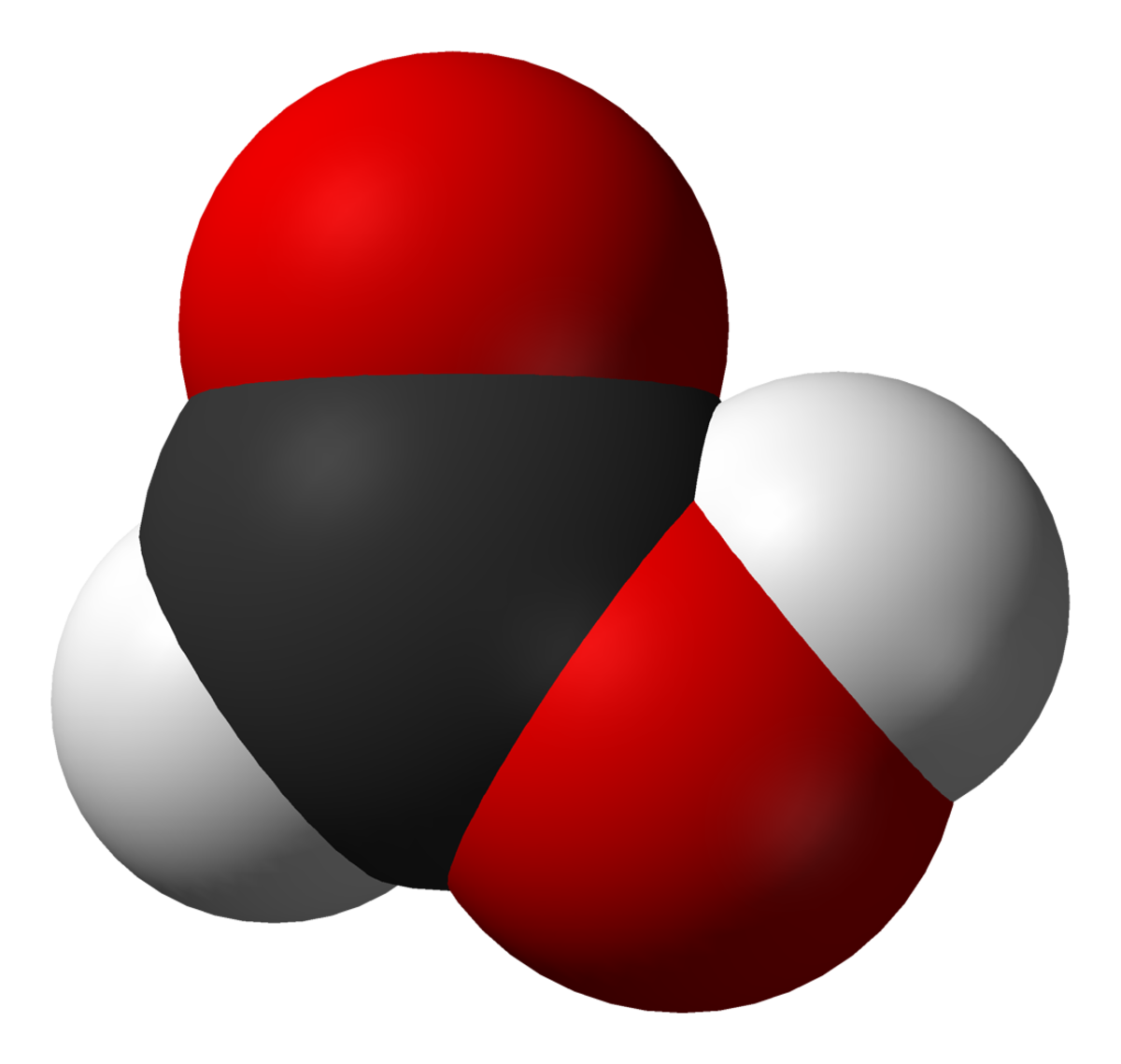
L'acide méthanoïque (appelé aussi acide formique) est le plus simple des acides carboxyliques. Sa formule chimique est CH2O2 ou HCOOH. Sa base conjuguée est l'ion méthanoate (formiate) de formule HCOO-. Il s'agit d'un acide faible qui se présente sous forme de liquide incolore à odeur pénétrante.
Dans la nature on le trouve dans le dard et les piqûres de plusieurs insectes de l'ordre des hyménoptères, comme les abeilles et les fourmis, mais aussi sur les poils qui composent les feuilles de certaines plantes de la famille des urticacées (orties). Son nom vient du mot latin formica qui signifie fourmis, car sa première isolation a été réalisée par distillation de corps de fourmis.




















































